8.探究新制饱和氯水成分的实验中,以下根据实验现象得出的结论错误的是( )
| A. | 将氯水滴加在蘸有红墨水的布条上,过一会儿红色布条会褪色,说明氯水中含有Cl2 | |
| B. | 向氯水中滴加硝酸酸化的AgNO3溶液,产生白色沉淀,说明氯水中含有Cl- | |
| C. | 向氯水中加入NaHCO3粉末,有气泡产生说明,氯水中含有H+ | |
| D. | 向FeCl2溶液中滴加氯水,溶液颜色变成棕黄色说明氯水中含有HClO |
7.下列化学反应对应的离子方程式书写正确的是( )
| A. | 漂白粉溶液在空气中生效:Ca2++2ClO-+CO2+H2O=2HClO+CaCO3↓ | |
| B. | 用KIO3氧化酸性溶液中的KI:5I-+IO3-+3H2O=3I2+6OH- | |
| C. | 氯化铁溶液与铜反应:Fe3++Cu=Fe2++Cu2+ | |
| D. | 0.01 mol•L-1NH4Al(SO4)2溶液与0.02 mol•L-1Ba(OH)2溶液等体积混合:NH4++Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+Al(OH)3↓+NH3•H2O |
6.利用右图实验装置,能得出相应实验结论的是( )
| ① | ② | ③ | 实验结论 |  | |
| A | 浓醋酸 | CaCO3 | Ca(ClO)2 | 酸性:醋酸>碳酸>次氯酸 | |
| B | 浓硫酸 | 蔗糖 | 溴水 | 浓硫酸具有脱水性、氧化性 | |
| C | 浓硫酸 | CuS | KMnO4 | H2S具有还原性 | |
| D | 盐酸 | Na2CO3 | Na2SiO3 | 非金属性:Cl>C>Si |
| A. | A | B. | B | C. | C | D. | D |
5.下列离子或分子组在溶液中能大量共存的是( )
| A. | K+ NO3- I- H2SO3 | B. | Na+ Fe3+ NO3- SCN- | ||
| C. | K+ AlO2- CO32- Al3+ | D. | NH4+ Mg2+ SO42- CH3COOH |
4.某澄清、透明的浅黄色溶液中,可能含有下列八种离子:Na+、NH4+、Fe3+、Ba2+、Al3+、SO42-、HCO3-、I-,在设计检验方案前的初步分析中,可确定该溶液中能大量存在的离子最多有( )
| A. | 4种 | B. | 5种 | C. | 6种 | D. | 7种 |
2.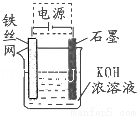 铁及其化合物在生产、生活中有广泛应用.请回答下列问题:
铁及其化合物在生产、生活中有广泛应用.请回答下列问题:
(一)高炉炼铁过程中发生的主要反应为:$\frac{1}{3}$Fe2O3(s)+CO(g)?$\frac{2}{3}$Fe(s)+CO2(g)
已知该反应在不同温度下的平衡常数如下:
(1)该反应的平衡常数表达式K=$\frac{c(C{O}_{2})}{c(CO)}$;△H<0(填“>”、“<”或“=”).
(2)欲提高上述反应中CO的平衡转化率,可采取的措施是B.
A.提高反应温度 B.移出部分CO2
C.加入合适的催化剂 D.减小容器的容积
(3)在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,此时υ正>υ逆(填“>”、“<”或“=”).经过10min,在1000℃达到平衡,则该时间范围内反应的平均反应速率υ(CO2)=0.008 mol/(L•min).
(二)高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂.
(4)一定条件下Fe(OH)3与KClO在KOH溶液中反应可制得K2FeO4,其中反应的氧化剂是KClO;生成0.5mol K2FeO4转移电子的物质的量是1.5mol.
(5)从环境保护的角度看,制备K2FeO4较好的方法为电解法,其装置如图所示.电解过程中阳极的电极反应式为Fe+8OH--6e-═FeO42-+4H2O.
 铁及其化合物在生产、生活中有广泛应用.请回答下列问题:
铁及其化合物在生产、生活中有广泛应用.请回答下列问题:(一)高炉炼铁过程中发生的主要反应为:$\frac{1}{3}$Fe2O3(s)+CO(g)?$\frac{2}{3}$Fe(s)+CO2(g)
已知该反应在不同温度下的平衡常数如下:
| 温度/℃ | 1000 | 1115 | 1300 |
| 平衡常数 | 4.0 | 3.7 | 3.5 |
(2)欲提高上述反应中CO的平衡转化率,可采取的措施是B.
A.提高反应温度 B.移出部分CO2
C.加入合适的催化剂 D.减小容器的容积
(3)在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,此时υ正>υ逆(填“>”、“<”或“=”).经过10min,在1000℃达到平衡,则该时间范围内反应的平均反应速率υ(CO2)=0.008 mol/(L•min).
(二)高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂.
(4)一定条件下Fe(OH)3与KClO在KOH溶液中反应可制得K2FeO4,其中反应的氧化剂是KClO;生成0.5mol K2FeO4转移电子的物质的量是1.5mol.
(5)从环境保护的角度看,制备K2FeO4较好的方法为电解法,其装置如图所示.电解过程中阳极的电极反应式为Fe+8OH--6e-═FeO42-+4H2O.
1.现有常温下的五种溶液(如下表)
下列有关叙述中正确的是( )
| ① | ② | ③ | ④ | ⑤ | |
| 溶液 | 氨水 | 氢氧化钠 | 醋酸 | 盐酸 | 醋酸钠 |
| pH | 11 | 11 | 3 | 3 | 8.3 |
| A. | 分别将①、②、③、④加水稀释100倍,稀释后四种溶液的pH:①>②>④>③ | |
| B. | 五种溶液中,水电离出的c(H+)最小的是⑤ | |
| C. | 将①、④两种溶液等体积混合,所得溶液中:c(Cl-)>c(NH4+)>c(H+)>c(OH-) | |
| D. | 在⑤中加入适量的④至溶液呈中性,所得溶液中c(CH3COO-)>c(Na+)>c(Cl-)>c(H+)=c(OH-) |
20.下列有关物质分类或归类正确的是( )
①混合物:盐酸、塑料、碱石灰
②电解质:胆矾、冰醋酸、氯化铝
③化合物:CaCl2、HD、NaOH
④同分异构体:C60、金刚石、石墨
⑤放热反应:盐酸与氢氧化钠、过氧化氢分解、浓硫酸溶于水.
0 169024 169032 169038 169042 169048 169050 169054 169060 169062 169068 169074 169078 169080 169084 169090 169092 169098 169102 169104 169108 169110 169114 169116 169118 169119 169120 169122 169123 169124 169126 169128 169132 169134 169138 169140 169144 169150 169152 169158 169162 169164 169168 169174 169180 169182 169188 169192 169194 169200 169204 169210 169218 203614
①混合物:盐酸、塑料、碱石灰
②电解质:胆矾、冰醋酸、氯化铝
③化合物:CaCl2、HD、NaOH
④同分异构体:C60、金刚石、石墨
⑤放热反应:盐酸与氢氧化钠、过氧化氢分解、浓硫酸溶于水.
| A. | ①⑤ | B. | ②④ | C. | ①③ | D. | ①② |
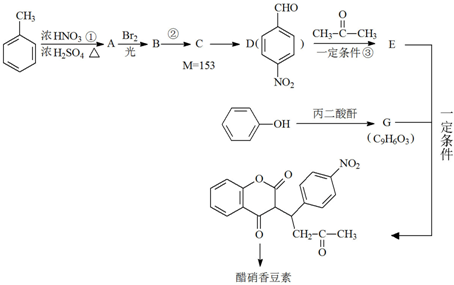
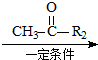 R1-CH=
R1-CH=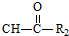 +H2O
+H2O 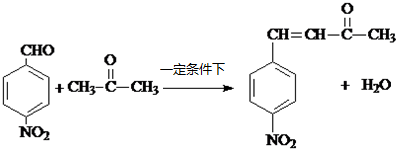
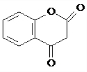 .
.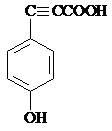 .
.