题目内容
4.某澄清、透明的浅黄色溶液中,可能含有下列八种离子:Na+、NH4+、Fe3+、Ba2+、Al3+、SO42-、HCO3-、I-,在设计检验方案前的初步分析中,可确定该溶液中能大量存在的离子最多有( )| A. | 4种 | B. | 5种 | C. | 6种 | D. | 7种 |
分析 某澄清、透明的浅黄色溶液中,一定含Fe3+,与Fe3+反应的离子一定不能大量存在,并结合溶液为电中性来解答.
解答 解:某澄清、透明的浅黄色溶液中,一定含Fe3+,与HCO3-发生相互促进水解反应,与I-发生氧化还原反应,则一定不含HCO3-、I-,
溶液为电中性,则一定含阴离子为SO42-,
与SO42-反应的Ba2+不能存在,
则能大量存在的离子最多有Na+、NH4+、Fe3+、Al3+、SO42-,
故选B.
点评 本题考查离子的共存,为高频考点,把握常见离子之间的反应为解答的关键,侧重氧化还原反应、水解反应的离子共存考查,综合性较强,题目难度不大.

练习册系列答案
相关题目
12.目前,科学界似合成一种“双重结构”的球形分子,即在球形C60容纳在球形Si60中形成的分子,外面的硅原子与里面的碳原子以共价键结合.关于这种“双重结构”的球形分子,下列叙述错误的是( )
| A. | 一个“双重结构”的分子实际上是两个分子 | |
| B. | 该分子原子间都以共价键相连接 | |
| C. | 该物质是一种新的化合物 | |
| D. | 该物质的相对分子质量为2400 |
19.A元素原子的第2层比B元素原子的第2层少3个电子,B元素的原子核外电子总数比A元素原子的核外电子总数多5个,则A与B可形成的化合物类型为( )
| A. | AB | B. | BA2 | C. | AB4 | D. | B3A2 |
16.下列对一些实验事实和理论解释正确的是( )
| 选项 | 实验事实 | 理论解释 |
| A | HCl气体溶于水,能导电 | HCl为离子化合物 |
| B | HBr的酸性强于HCl的酸性 | Br的非金属性比Cl强 |
| C | K3C60在熔融状态下能够导电 | K3C60中含有离子键 |
| D | HF的沸点高于HCl | F的非金属性比Cl强 |
| A. | A | B. | B | C. | C | D. | D |
13.将一定质量的铁、氧化铁、氧化铜的混合物粉末放入70mL 4.0mol/L盐酸中,充分反应后产生448mL H2(标准状况),残留固体0.64g.过滤,滤液中无Cu2+.将滤液加水稀释到200mL,测得其中c(H+)为0.20mol/L.则原混合物中单质铁的质量是( )
| A. | 2.80g | B. | 3.25g | C. | 3.36g | D. | 4.48g |
14.下列说法正确的是( )
| A. | 凡是卤代烃一定能发生消去反应 | |
| B. | 酯化反应中一般是羧酸脱去羧基中的羟基,醇脱去羟基上的氢原子 | |
| C. | 浓H2SO4在酯化反应中只起催化剂的作用 | |
| D. | 欲使酯化反应生成的酯分离并提纯,可以将弯导管伸入饱和Na2CO3溶液的液面下,再用分液漏斗分离 |
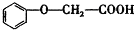 发生酯化反应的产物A是一种食用香料.甲分子为链状结构且不含甲基.回答下列问题:
发生酯化反应的产物A是一种食用香料.甲分子为链状结构且不含甲基.回答下列问题: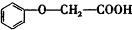 的分子式为C8H8O3.
的分子式为C8H8O3.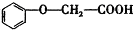 有多种同分异构体,其中属于酯类,能使FeCl3溶液显紫色,且苯环上的一氯代物有两种的同分异构体的结构简式为
有多种同分异构体,其中属于酯类,能使FeCl3溶液显紫色,且苯环上的一氯代物有两种的同分异构体的结构简式为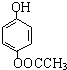 、
、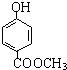 、
、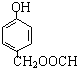 (其中一种)(任写一种).
(其中一种)(任写一种).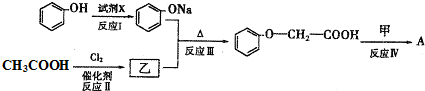
 .
.
 、
、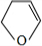 .
.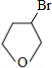 +NaOH$→_{△}^{H_{2}O}$
+NaOH$→_{△}^{H_{2}O}$ +NaBr.
+NaBr.