题目内容
1.现有常温下的五种溶液(如下表)| ① | ② | ③ | ④ | ⑤ | |
| 溶液 | 氨水 | 氢氧化钠 | 醋酸 | 盐酸 | 醋酸钠 |
| pH | 11 | 11 | 3 | 3 | 8.3 |
| A. | 分别将①、②、③、④加水稀释100倍,稀释后四种溶液的pH:①>②>④>③ | |
| B. | 五种溶液中,水电离出的c(H+)最小的是⑤ | |
| C. | 将①、④两种溶液等体积混合,所得溶液中:c(Cl-)>c(NH4+)>c(H+)>c(OH-) | |
| D. | 在⑤中加入适量的④至溶液呈中性,所得溶液中c(CH3COO-)>c(Na+)>c(Cl-)>c(H+)=c(OH-) |
分析 A.pH分别相同的弱碱和强碱、弱酸和强酸溶液,弱电解质溶液在稀释过程中会继续电离,所以稀释相同的倍数时,弱碱中氢氧根离子浓度大于强碱溶液、弱酸中氢离子浓度大于强酸溶液;
B.酸或碱抑制水电离,含有弱离子的盐促进水电离,且酸中氢离子浓度或碱中氢氧根离子浓度越大,抑制水电离程度越大;
C.一水合氨是弱电解质、HCl是强电解质,pH=11的氨水浓度大于pH=3的盐酸浓度,二者等体积混合,氨水有剩余,溶液呈碱性;
D.在⑤中加入适量的④至溶液呈中性,则c(H+)=c(OH-),结合电荷守恒判断离子浓度大小.
解答 解:A.pH分别相同的弱碱和强碱、弱酸和强酸溶液,弱电解质溶液在稀释过程中会继续电离,所以稀释相同的倍数时,弱碱中氢氧根离子浓度大于强碱溶液、弱酸中氢离子浓度大于强酸溶液,所以pH大小顺序是:①>②>④>③,故A正确;
B.酸或碱抑制水电离,含有弱离子的盐促进水电离,且酸中氢离子浓度或碱中氢氧根离子浓度越大,抑制水电离程度越大,醋酸钠促进水电离,氨水、氢氧化钠、醋酸和盐酸都抑制水电离,所以水电离出c(H+)最大的是⑤,故B错误;
C.一水合氨是弱电解质、HCl是强电解质,pH=11的氨水浓度大于pH=3的盐酸浓度,二者等体积混合,氨水有剩余,溶液呈碱性,则c(H+)<c(OH-),结合电荷守恒得c(Cl-)<c(NH4+),故C错误;
D.在⑤中加入适量的④至溶液呈中性,则c(H+)=c(OH-),结合电荷守恒得c(Na+)>c(CH3COO-),加入盐酸的量很少,所以c(CH3COO-)>c(Cl-),则离子浓度大小顺序是c(Na+)>c(CH3COO-)>c(Cl-)>c(H+)=c(OH-),故D错误;
故选A.
点评 本题考查离子浓度大小比较,涉及盐类水解和弱电解质电离,为高频考点,明确溶液中的溶质及溶液酸碱性是解本题关键,再结合电荷守恒、物料守恒判断,易错选项是D.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 常温下,0.1mol•L-1的NH4NO3溶液中氮原子数为0.2NA | |
| B. | 标准状况下,5.6L CCl4含有的分子数为0.25 NA | |
| C. | 在标准状况下,2.8g N2和2.24LCO所含质子数均为1.4NA | |
| D. | 常温下,1 L pH=1的硫酸溶液中含有的H+数为0.05NA |
| A. | 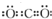 | B. | 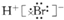 | C. | 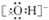 | D. | 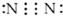 |
| A. | 对于同一物质来讲,熵值的大小与其状态有关,固态物质的熵值最小 | |
| B. | 强电解质的水溶液导电能力不一定比弱电解质水溶液的导电能力强 | |
| C. | pH=5的溶液和pH=3的溶液相比,前者c(H+)是后者的100倍 | |
| D. | 在25℃,101KPa时,1mol碳完全燃烧生成二氧化碳气体时放出的热量为碳的燃烧热 |
| ① | ② | ③ | 实验结论 |  | |
| A | 浓醋酸 | CaCO3 | Ca(ClO)2 | 酸性:醋酸>碳酸>次氯酸 | |
| B | 浓硫酸 | 蔗糖 | 溴水 | 浓硫酸具有脱水性、氧化性 | |
| C | 浓硫酸 | CuS | KMnO4 | H2S具有还原性 | |
| D | 盐酸 | Na2CO3 | Na2SiO3 | 非金属性:Cl>C>Si |
| A. | A | B. | B | C. | C | D. | D |
| A. | 二氧化硫有漂白性,常用作棉、麻、纸张和食品的漂白 | |
| B. | 氢氧化铁溶胶、水玻璃、淀粉溶液、PM2.5微粒均具有丁达尔效应 | |
| C. | “地沟油”经过加工处理后,可以用来制肥皂和生物柴油 | |
| D. | 汽车尾气污染物中含有氮的氧化物,是汽油不完全燃烧造成的 |
| A. | ④>③=②>① | B. | ④>③>②>① | C. | ②>④>③>① | D. | ②>③=④>① |

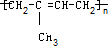
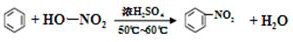 .
.