题目内容
2. 铁及其化合物在生产、生活中有广泛应用.请回答下列问题:
铁及其化合物在生产、生活中有广泛应用.请回答下列问题:(一)高炉炼铁过程中发生的主要反应为:$\frac{1}{3}$Fe2O3(s)+CO(g)?$\frac{2}{3}$Fe(s)+CO2(g)
已知该反应在不同温度下的平衡常数如下:
| 温度/℃ | 1000 | 1115 | 1300 |
| 平衡常数 | 4.0 | 3.7 | 3.5 |
(2)欲提高上述反应中CO的平衡转化率,可采取的措施是B.
A.提高反应温度 B.移出部分CO2
C.加入合适的催化剂 D.减小容器的容积
(3)在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,此时υ正>υ逆(填“>”、“<”或“=”).经过10min,在1000℃达到平衡,则该时间范围内反应的平均反应速率υ(CO2)=0.008 mol/(L•min).
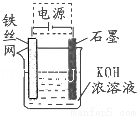
(二)高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂.
(4)一定条件下Fe(OH)3与KClO在KOH溶液中反应可制得K2FeO4,其中反应的氧化剂是KClO;生成0.5mol K2FeO4转移电子的物质的量是1.5mol.
(5)从环境保护的角度看,制备K2FeO4较好的方法为电解法,其装置如图所示.电解过程中阳极的电极反应式为Fe+8OH--6e-═FeO42-+4H2O.
分析 (一)(1)化学平衡常数,是指在一定温度下,可逆反应达到平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,据此书写,注意固体、纯液体的浓度为常数,不需要写固体、纯液体;由表中数据可知,温度越高平衡常数越小,故升高温度平衡向逆反应移动,正反应为放热反应;
(2)提高CO的平衡转化率,应使平衡向正反应移动,但不能增大CO的用量,结合选项根据平衡移动原理分析;
(3)依据浓度商计算和平衡常数比较分析平衡移动方向;令平衡时CO的物质的量变化为nmol,利用三段式表示出平衡时CO、CO2的物质的量,化学计量数都是1,利用物质的量代替浓度代入平衡常数计算n的值,进而计算CO2的浓度变化量,利用v=$\frac{△c}{△t}$计算v(CO2);
(二)(4)得电子化合价降低的反应物是氧化剂,根据高铁酸钾和转移电子之间的关系式计算;
(5)电解时阳极Fe失电子发生氧化反应,据此书写电极反应方程式.
解答 解:(一)(1)平衡常数指:生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,固体、纯液体的浓度为常数,所以反应:$\frac{1}{3}$Fe2O3(s)+CO(g)?$\frac{2}{3}$Fe(s)+CO2(g)的平衡常数k=$\frac{c(C{O}_{2})}{c(CO)}$,由表中数据可知,温度越高平衡常数越小,故升高温度平衡向逆反应移动,正反应为放热反应,即△H<0,
故答案为:$\frac{c(C{O}_{2})}{c(CO)}$;<;
(2)A.该反应正反应是放热反应,提高反应温度,平衡向逆反应移动,CO的平衡转化率降低,故A错误;
B.移出部分CO2平衡向正反应移动,CO的平衡转化率增大,故B正确;
C.加入合适的催化剂平衡不移动,故C错误;
D.反应前后气体的物质的量不变,减小容器的容积,增大压强平衡不移动,CO的平衡转化率不变,故D错误;
故选B;
(3)在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,依据浓度商Q=1<K=4,说明反应正向进行,正反应速率大于逆反应速率;
令平衡时CO的物质的量变化为nmol,则:
$\frac{1}{3}$Fe2O3(s)+CO(g)?$\frac{2}{3}$Fe(s)+CO2(g)
开始(mol):1 0
变化(mol):n n
平衡(mol):1-n n
所以K=$\frac{n}{1-n}$=4,解得n=0.8,
所以υ(CO2)=$\frac{0.8mol}{\frac{10L}{10min}}$=0.008 mol/(L•min),
故答案为:>;0.008 mol/(L•min);
(二)(4)该反应中,铁元素的化合价由+3价变为+6价,氯元素化合价由+1价变为-1价,所以氢氧化铁是还原剂,次氯酸钾是氧化剂,生成0.5mol K2FeO4转移的电子的物质的量=0.5mol×(6-3)=1.5mol,
故答案为:KClO;1.5;
(5)Na2FeO4能消毒、净水的原因高价铁具有氧化性,能消毒杀菌,生成Fe3+形成胶体,具有吸附悬浮物的净水的作用,电解时阳极Fe失电子发生氧化反应,电极反应方程式为Fe+8OH--6e-═FeO42-+4H2O;
故答案为:Fe+8OH--6e-═FeO42-+4H2O.
点评 本题考查平衡常数和平衡的移动等,掌握化学平衡常数的表达式的书写和平衡移动的原理应用是解答的关键,注意掌握化学平衡常数的应用:用来判断反应进行的程度,判断反应的热效应,判断反应进行的方向,用来计算物质的转化率,题目难度中等.

 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案| A. | H+、Fe2+、NO3-、SO42- | B. | Na+、H+、AlO2-、HCO3- | ||
| C. | Ca2+、Fe3+、CO32-、CH3COO- | D. | Ca2+、Na+、HCO3-、Cl- |
| A. | ①②⑤ | B. | ①②④ | C. | ②③④ | D. | ③④⑤ |
| A. | 101kPa时,能表示H2燃烧热的热化学方程式为:H2(g)+Cl2(g)=2HCl(g);△H=-183kJ/mol | |
| B. | 向Mg(OH)2悬浊液中滴入饱和NH4Cl溶液,沉淀溶解,其离子方程式为:Mg(OH)2+2H+═Mg2++2H2O | |
| C. | 电解精炼铜的阳极反应式为:Cu2++2e-=Cu | |
| D. | 硫代硫酸钠溶液中加入稀硫酸变浑浊:S2O32-+2H+=S↓+SO2↑+H2O |
| A. | 漂白粉溶液在空气中生效:Ca2++2ClO-+CO2+H2O=2HClO+CaCO3↓ | |
| B. | 用KIO3氧化酸性溶液中的KI:5I-+IO3-+3H2O=3I2+6OH- | |
| C. | 氯化铁溶液与铜反应:Fe3++Cu=Fe2++Cu2+ | |
| D. | 0.01 mol•L-1NH4Al(SO4)2溶液与0.02 mol•L-1Ba(OH)2溶液等体积混合:NH4++Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+Al(OH)3↓+NH3•H2O |
| A. | 非金属原子间以共价键结合的物质都是共价化合物 | |
| B. | 非极性共价键只能存在于非金属单质中,不可能存在于化合物中 | |
| C. | 含有离子键的化合物一定是离子化合物,在离子化合物中可以含有非极性共价键 | |
| D. | 凡是能电离出离子的化合物都是离子化合物 |
| A. | 绿色植物光合作用过程中是由太阳能转变成化学能 | |
| B. | 研制乙醇汽油技术,可降低机动车辆尾气中有害气体的排放 | |
| C. | 煤、石油、天然气属于可再生能源 | |
| D. | 利用太阳能等清洁能源代替化石燃料,有利于节约资源、保护环境 |
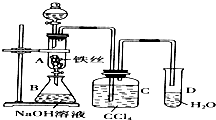 某化学课外小组用右图装置制取溴苯.先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A中(A下端活塞关闭).(已知此反应属于放热反应;苯和液溴都易挥发)
某化学课外小组用右图装置制取溴苯.先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A中(A下端活塞关闭).(已知此反应属于放热反应;苯和液溴都易挥发)