18.下面是某加碘食盐包装袋上的部分国表文字(I为碘元素符号).由此,你得到的信息和做出的推测是( )
配料表
配料表
| 氯化钠(NaCl) | ≥98.0%(以NaCl计) |
| 碘酸钾(KIO3) | (35±15)mg/Kg(以I计) |
| A. | 此食盐是纯净物 | |
| B. | “加碘食盐”中的“碘”是指碘单质 | |
| C. | 1Kg此食盐中含碘酸钾(35±15)mg | |
| D. | “菜未烧熟不宜加入加碘盐”的原因可能是碘酸钾受热不稳定 |
17.有三种化合物:①NaHCO3、②Al(OH)3、③H2NCH2COOH,跟盐酸和氢氧化钠溶液都能反应的是( )
| A. | 只有② | B. | 只有①② | C. | 只有②③ | D. | ①②③ |
16.分析用石灰水保存鲜蛋的原理如下:
(1)石灰水是碱性物质,能渗入蛋内和酸性物质反应,防止酸败;
(2)石灰水是电解质溶液,促使蛋白质凝聚;
(3)石灰水显弱碱性,有杀菌能力;
(4)石灰水能与鲜蛋呼出的CO2生成CaCO3薄膜,起保护作用.
其中正确的是( )
(1)石灰水是碱性物质,能渗入蛋内和酸性物质反应,防止酸败;
(2)石灰水是电解质溶液,促使蛋白质凝聚;
(3)石灰水显弱碱性,有杀菌能力;
(4)石灰水能与鲜蛋呼出的CO2生成CaCO3薄膜,起保护作用.
其中正确的是( )
| A. | (1)(2) | B. | (1)(2)(3) | C. | (3)(4) | D. | (2)(3)(4) |
15.对于淀粉下列叙述中,不正确的是( )
| A. | 淀粉属于天然有机高分子化合物 | B. | 遇I-能变蓝色 | ||
| C. | 淀粉不溶于冷水 | D. | 淀粉在人体内能水解生成葡萄糖 |
14.向淀粉溶液中加入少量的稀硫酸并加热,使淀粉发生水解,为测定其水解程度,所需的试剂是( )
①NaOH溶液 ②银氨溶液 ③新制Cu(OH)2悬浊液 ④碘水 ⑤BaCl2溶液.
①NaOH溶液 ②银氨溶液 ③新制Cu(OH)2悬浊液 ④碘水 ⑤BaCl2溶液.
| A. | ④ | B. | ③⑤ | C. | ②④ | D. | ①③④ |
13.在冶金工业上,均不能用化学还原法制得的一组金属是( )
| A. | K、Na、Al | B. | Na、K、Zn、Fe | C. | Zn、Fe、Cu、Ag | D. | Mg、Al、Zn、Fe |
12.下列说法错误的是( )
| A. | 阿司匹林属于解热镇痛药 | |
| B. | 青霉素有青霉素F、G、X、K、V | |
| C. | 胃舒平、苏打片均属于抗酸药 | |
| D. | 青霉素在体内水解可得到一类碱性物质 |
11.为了维持生命和健康,人要从食物中摄取营养素,下列物质中不属于营养素的是( )
| A. | 葡萄糖 | B. | 食醋 | C. | 水 | D. | 芝麻油 |
10.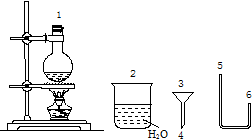 某化学小组在实验室用下图提供的仪器制备溴乙烷.
某化学小组在实验室用下图提供的仪器制备溴乙烷.
已知:
①反应原理:NaBr+H2SO4(较浓)$\frac{\underline{\;\;△\;\;}}{\;}$NaHSO4+HBr
HBr+C2H5OH$\frac{\underline{\;\;△\;\;}}{\;}$C2H5Br+H2O
②反应物用量:NaBr(S)25g,无水乙醇15mL,浓H2SO430mL,水15mL
③溴乙烷和乙醇的部分物理性质如下表
回答下列问题:
(1)连接上述仪器的顺序是:1接6接5接( 4 )接( 3 )接2(填数字).你认为反应后溴乙烷在烧杯(填“烧瓶”或“烧杯”)中
(2)由于浓硫酸具有强氧化性,反应产生副产物,使粗制溴乙烷常呈黄色,该副产物是Br2(写化学式),除去该杂质的试剂和方法是NaOH溶液,分液取下层,为了减少该副产物的生成,本实验采取了反应物中加入水,稀释浓硫酸,降低其氧化性,减少副产品溴的生成的措施.
0 168999 169007 169013 169017 169023 169025 169029 169035 169037 169043 169049 169053 169055 169059 169065 169067 169073 169077 169079 169083 169085 169089 169091 169093 169094 169095 169097 169098 169099 169101 169103 169107 169109 169113 169115 169119 169125 169127 169133 169137 169139 169143 169149 169155 169157 169163 169167 169169 169175 169179 169185 169193 203614
 某化学小组在实验室用下图提供的仪器制备溴乙烷.
某化学小组在实验室用下图提供的仪器制备溴乙烷.已知:
①反应原理:NaBr+H2SO4(较浓)$\frac{\underline{\;\;△\;\;}}{\;}$NaHSO4+HBr
HBr+C2H5OH$\frac{\underline{\;\;△\;\;}}{\;}$C2H5Br+H2O
②反应物用量:NaBr(S)25g,无水乙醇15mL,浓H2SO430mL,水15mL
③溴乙烷和乙醇的部分物理性质如下表
| 密度/g•mL-1 | 沸点/℃ | 溶解性 | |
| 溴乙烷 | 1.461 | 38 | 难溶于水 |
| 乙醇 | 0.789 | 78 | 易溶于水 |
(1)连接上述仪器的顺序是:1接6接5接( 4 )接( 3 )接2(填数字).你认为反应后溴乙烷在烧杯(填“烧瓶”或“烧杯”)中
(2)由于浓硫酸具有强氧化性,反应产生副产物,使粗制溴乙烷常呈黄色,该副产物是Br2(写化学式),除去该杂质的试剂和方法是NaOH溶液,分液取下层,为了减少该副产物的生成,本实验采取了反应物中加入水,稀释浓硫酸,降低其氧化性,减少副产品溴的生成的措施.