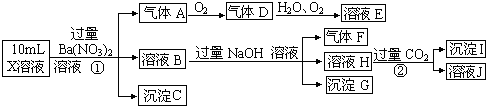
15.下列说法中正确的是( )
| A. | 0.1mol/L (NH4)2SO4溶液中:c(SO42-)<c(NH4+) | |
| B. | 相同温度下,0.6 mol/L 氨水溶液与0.3 mol/L 氨水溶液中c(OH-)之比是2:1 | |
| C. | 向0.1 mol/L NaNO3溶液中滴加稀HNO3使溶液中pH=5,则混合溶液中c(Na+)<c(NO3-) | |
| D. | 常温下向CH3COONa溶液中加入适量CH3COOH溶液,使混合液的pH=7,则混合液中c(Na+)<c(CH3COO-) |
14.铁棒和石墨棒用导线连接后,浸入0.01mol/L 的氯化钠溶液中,下列说法正确的是( )
| A. | 铁棒附近产生OH- | B. | 铁棒质量减少 | ||
| C. | 石墨棒上放出氯气 | D. | 石墨棒上放出氧气 |
13.Na2O2、CaC2都能与水反应,且反应中都有气体放出.下列说法正确的是( )
| A. | 都属于氧化还原反应 | B. | 生成的气体均为氧化产物 | ||
| C. | 反应物水均作氧化剂 | D. | 反应均放热 |
11.用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 在反应4FeS2+11O2=2Fe2O3+8SO2中,每生成1molSO2转移电子数为5.5NA | |
| B. | 标准状况下,11.2LO2参加反应转移的电子数一定为2NA | |
| C. | t℃时,MgCO3的Ksp=4×10-6,则饱和溶液中含Mg2+数目为2×10-3NA | |
| D. | 50g46%的乙醇水溶液中,含氢原子总数目为3NA |
10.下列有关实验原理或操作正确的是( )
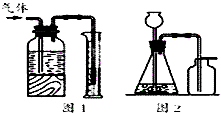

| A. | 用图1所示装置可测量产生气体的体积 | |
| B. | 用0.1000mol/L标准盐酸滴定未知浓度的氨水,用甲基橙作指示剂 | |
| C. | 用二氧化锰和浓盐酸制备少量氯气可在图2所示装置中进行 | |
| D. | 鉴别pH=8.3的NaOH溶液和pH=8.4的苯酚钠溶液,可选用广泛pH试纸检测 |
8.在一固定体积的密闭容器中,在850℃时发生如下反应:CO(g)+H2O(g)$\stackrel{催化剂}{?}$CO2(g)+H2(g),容器内各物质的浓度(mol/L)变化如下(在850℃时其化学平衡常数K=1.0).
(1)下列可以作为判断该反应已经达到化学平衡状态依据的是C.
A.容器内压强不变
B.CO的消耗速率等于CO2的生成速率
C.混合气体中CO的体积分数不变
D.c(CO2):c(H2)=1:l
(2)上表中:cl=0.08mol/L.
0 168926 168934 168940 168944 168950 168952 168956 168962 168964 168970 168976 168980 168982 168986 168992 168994 169000 169004 169006 169010 169012 169016 169018 169020 169021 169022 169024 169025 169026 169028 169030 169034 169036 169040 169042 169046 169052 169054 169060 169064 169066 169070 169076 169082 169084 169090 169094 169096 169102 169106 169112 169120 203614
| 时间/min | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | c3 |
A.容器内压强不变
B.CO的消耗速率等于CO2的生成速率
C.混合气体中CO的体积分数不变
D.c(CO2):c(H2)=1:l
(2)上表中:cl=0.08mol/L.