题目内容
11.用NA表示阿伏加德罗常数的值,下列叙述正确的是( )| A. | 在反应4FeS2+11O2=2Fe2O3+8SO2中,每生成1molSO2转移电子数为5.5NA | |
| B. | 标准状况下,11.2LO2参加反应转移的电子数一定为2NA | |
| C. | t℃时,MgCO3的Ksp=4×10-6,则饱和溶液中含Mg2+数目为2×10-3NA | |
| D. | 50g46%的乙醇水溶液中,含氢原子总数目为3NA |
分析 A、反应4FeS2+11O2=2Fe2O3+8SO2转移44mol电子;
B、氧气反应后的产物中,化合价有-1、-2价两种;
C、溶液的体积未知;
D、乙醇溶液中氢元素存在水和乙醇中.
解答 解:A、反应4FeS2+11O2=2Fe2O3+8SO2中铁元素和硫元素被氧化,氧元素被还原,此反应转移44mol电子,生成8mol二氧化硫,故生成1molSO2转移电子数为5.5NA,故A正确;
B、由于反应产物中氧元素的化合价没有确定,故标况下11.2LO2参加反应转移的电子数不一定是2NA,故B错误;
C、溶液体积不明确,故溶液中的镁离子的个数无法计算,故C错误;
D、50g 46%的乙醇水溶液中乙醇质量为23g,物质的量为0.5mol,溶液中含氢元素的还有水中,所以含氢原子总数目大于3NA,故D错误;
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
1.高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压.高铁电池的总反应为:3Zn+2K2FeO4+8H2O═3Zn(OH)2+2Fe(OH)3+4KOH 下列叙述正确的是( )
| A. | 放电时负极反应为:3Zn-6e-═3Zn2+ | |
| B. | 放电时正极反应为:2FeO42-+6e-+8H2O═2Fe(OH)3+10OH- | |
| C. | 放电时每转移3mol电子,正极有1mol K2FeO4被氧化 | |
| D. | 放电时负极附近溶液的碱性减弱 |
19.下列溶液中溶质的物质的量浓度为1mol/L的是( )
| A. | 含K+为2mol的K2SO4溶液 | |
| B. | 将58.5gNaCl溶解于1L水中 | |
| C. | 将0.5mol/L的NaNO3溶液100mL加热蒸发掉50克水的溶液 | |
| D. | 将80gSO3溶于水并配成1L溶液 |
16.化学反应的能量变化、速率、限度是化学研究的重要内容.
(1)有关研究需要得到C3H8(g)=3C(石墨,s)+4H2(g)的△H,但测定实验难进行.
设计如图1可计算得到:
①△H>0(填>、<或=)
②△H=△H1-△H2-△H3.(用图中其它反应的反应热表示)
(2)甲酸、甲醇、甲酸甲酯是重要化工原料.它们的一些性质如下:
工业制备甲酸原理:HCOOCH3(l)+H2O(l)$\stackrel{H+}{?}$ HCOOH(l)+CH3OH(l),反应吸热,但焓变的值很小.常温常压下,水解反应速率和平衡常数都较小.
①工业生产中,反应起始,在甲酸甲酯和水的混合物中加入少量甲酸和甲醇,从反应速率和限度的角度分析所加甲酸和甲醇对甲酸甲酯水解的影响.甲醇:是很好的溶剂,能溶于水和HCOOCH3,增大反应接触面积,加快反应速率;同时,甲醇也是生成物,生物浓度增加,不利于平衡右移.甲酸:甲酸能电离出H+作催化剂能加快反应速率,同时,甲酸也是生成物,生成物浓度增加,不利于平衡右移.某小组通过试验研究反应HCOOCH3转化率随时间变化的趋势,在温度T1下,采用酯水比为1:2进行实验,测得平衡是HCOOCH3的转化率为25%.
②预测HCOOCH3转化率随时间的变化趋势并画图2表示.
③该反应在温度T1下的平衡常数K=0.048.(保留两位有效数字)
(3)HCOOH成为质子膜燃料电池的燃料有很好的发展前景.写出该燃料电池的电极反应式:O2 +4e-+4H+=2H2O; 2HCOOH-4e-=2CO2 ↑+4H+.
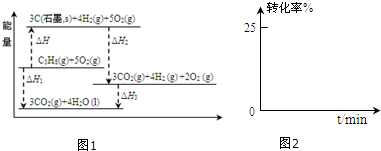
(1)有关研究需要得到C3H8(g)=3C(石墨,s)+4H2(g)的△H,但测定实验难进行.
设计如图1可计算得到:
①△H>0(填>、<或=)
②△H=△H1-△H2-△H3.(用图中其它反应的反应热表示)
(2)甲酸、甲醇、甲酸甲酯是重要化工原料.它们的一些性质如下:
| 物质 | HCOOH | CH3OH | HCOOCH3 |
| 主要 性质 | 无色液体,与水互溶 K(HCOOH)>K(CH3COOH) | 无色液体,与水互溶 | 无色液体,在水中溶解度小,与醇互溶 |
①工业生产中,反应起始,在甲酸甲酯和水的混合物中加入少量甲酸和甲醇,从反应速率和限度的角度分析所加甲酸和甲醇对甲酸甲酯水解的影响.甲醇:是很好的溶剂,能溶于水和HCOOCH3,增大反应接触面积,加快反应速率;同时,甲醇也是生成物,生物浓度增加,不利于平衡右移.甲酸:甲酸能电离出H+作催化剂能加快反应速率,同时,甲酸也是生成物,生成物浓度增加,不利于平衡右移.某小组通过试验研究反应HCOOCH3转化率随时间变化的趋势,在温度T1下,采用酯水比为1:2进行实验,测得平衡是HCOOCH3的转化率为25%.
②预测HCOOCH3转化率随时间的变化趋势并画图2表示.
③该反应在温度T1下的平衡常数K=0.048.(保留两位有效数字)
(3)HCOOH成为质子膜燃料电池的燃料有很好的发展前景.写出该燃料电池的电极反应式:O2 +4e-+4H+=2H2O; 2HCOOH-4e-=2CO2 ↑+4H+.
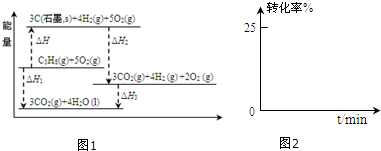
3.芜湖铁画是中国工艺美术百花园中的一朵奇葩,至今已有三百多年的历史.下列关于铁画生锈与防护的描述中不正确的是( )
| A. | 悬挂在干燥的环境中 | B. | 经常清扫表面的灰尘可以防止生锈 | ||
| C. | 表面涂漆防止生锈 | D. | 生锈时主要生成四氧化三铁 |
20.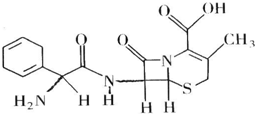 头孢拉定片(Cefradine Tablets),又称先锋,其结构式如图所示,有关该物质的描述正确的是( )
头孢拉定片(Cefradine Tablets),又称先锋,其结构式如图所示,有关该物质的描述正确的是( )
 头孢拉定片(Cefradine Tablets),又称先锋,其结构式如图所示,有关该物质的描述正确的是( )
头孢拉定片(Cefradine Tablets),又称先锋,其结构式如图所示,有关该物质的描述正确的是( )| A. | 分子式为C16H20N3O4S | |
| B. | 该物质在一定条件下能发生水解 | |
| C. | 该有机物质属于芳香族化合物 | |
| D. | 该物质不能与NaHCO3溶液反应放出CO2 |
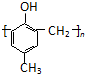 )的合成路线如下:
)的合成路线如下: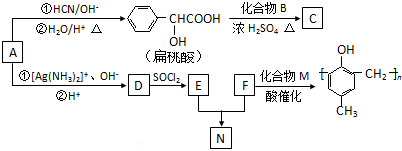
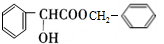 .
. .
.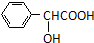 )有多种同分异构体.属于甲酸酯且含酚羟基的同分异构体有13种,写出其中一个含亚甲基(-CH2-)的同分异构体的结构简式
)有多种同分异构体.属于甲酸酯且含酚羟基的同分异构体有13种,写出其中一个含亚甲基(-CH2-)的同分异构体的结构简式 (任意一种).
(任意一种).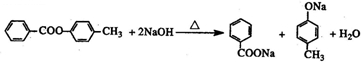 .
.