题目内容
15.下列说法中正确的是( )| A. | 0.1mol/L (NH4)2SO4溶液中:c(SO42-)<c(NH4+) | |
| B. | 相同温度下,0.6 mol/L 氨水溶液与0.3 mol/L 氨水溶液中c(OH-)之比是2:1 | |
| C. | 向0.1 mol/L NaNO3溶液中滴加稀HNO3使溶液中pH=5,则混合溶液中c(Na+)<c(NO3-) | |
| D. | 常温下向CH3COONa溶液中加入适量CH3COOH溶液,使混合液的pH=7,则混合液中c(Na+)<c(CH3COO-) |
分析 A、盐类的单水解程度很小;
B、相同条件下,浓度越大的弱电解质其电离程度越小;
C、根据电荷守恒判断;
D、溶液呈中性,则c(H+)=c(OH-),结合电荷守恒判断.
解答 解:A.硫酸铵溶液中铵根离子易水解而使溶液呈酸性c(H+)>c(OH- ),但较微弱,根据其化学式知,c(NH4+)>c(SO4 2- ),故A正确;
B.相同条件下,浓度越大的弱电解质其电离程度越小,所以0.6mol/L氨水溶液与0.3 mol/L氨水溶液中c(OH-)之比小于2:1,故B错误;
C.硝酸钠是强酸强碱盐,钠离子和硝酸根离子都不水解,加入硝酸后,溶液中存在电荷守恒:c(Na+)+c(H+)=c(NO3- )+c(OH-),由于混合后溶液的pH=5,故c(H+)>c(OH-),则c(Na+)<c(NO3- ),故C正确;
D.混合溶液呈中性,则c(H+)=c(OH-),溶液中存在电荷守恒则c(H+)+c(Na+)=c(CH3COO-)+c(OH-),所以c(Na+)=c(CH3COO-),故D错误;
故选AC.
点评 本题考查了离子浓度大小的比较,根据电荷守恒来分析解答,易错选项是C,难度不大.

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
5.下列说法正确的是( )
| A. | 某烷烃的结构为: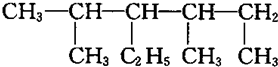 ,正确的命名是3,5-二甲基-4-乙基己烷 ,正确的命名是3,5-二甲基-4-乙基己烷 | |
| B. | 涤纶是由对苯二甲酸(PTA)和乙二醇(EG)通过加聚反应得到的 | |
| C. | 有机物CH3CH2CH(CH3)2的一氯代物有4种 | |
| D. | 有机同系物具有相同的通式,且组成相差若干个“CH2”,因此等质量的同系物燃烧耗氧相差物质的量为1.5nmol |
6.短周期主族元素X,Y,Z在周期表中的位置如表.下列说法正确的是( )
| Z | |
| X | Y |
| A. | 若它们的原子最外层电子数之和为11,则X为金属元素 | |
| B. | 三种元素原子半径由大到小的顺序一定是Y>X>Z | |
| C. | 若它们均为金属元素,则Y的最高价氧化物对应水化物的碱性最强 | |
| D. | Z元素的最高化合价一定大于X元素 |
10.下列有关实验原理或操作正确的是( )
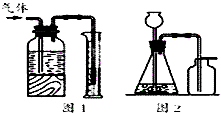

| A. | 用图1所示装置可测量产生气体的体积 | |
| B. | 用0.1000mol/L标准盐酸滴定未知浓度的氨水,用甲基橙作指示剂 | |
| C. | 用二氧化锰和浓盐酸制备少量氯气可在图2所示装置中进行 | |
| D. | 鉴别pH=8.3的NaOH溶液和pH=8.4的苯酚钠溶液,可选用广泛pH试纸检测 |
7.150ml 1mol/L的NaOH溶液吸收了2.24L CO2(标准状况下)则下列说法正确的是( )
| A. | HCO3-离子略多于CO32-离子 | |
| B. | HCO3-离子等于CO32-离子 | |
| C. | HCO3-离子略少于CO32-离子 | |
| D. | Na+离子数等于HCO3-和CO32-离子数之和 |
4.航天科学技术测得,三氧化二碳(C2O3) 是金星大气层的成分之一.下列说法正确的是( )
| A. | C2O3和CO2是同素异形体 | B. | C2O3和CO完全燃烧,产物都是CO2 | ||
| C. | C2O3和CO 都是酸性氧化物 | D. | C2O3和CO2都是碳酸的酸酐 |
