2.下列反应中前者属于取代反应,后者属于加成反应的是( )
| A. | 甲烷与氯气混合后光照反应;乙烯使酸性高锰酸钾溶液褪色 | |
| B. | 苯与硝酸在一定条件下反应生成硝基苯;乙烯与溴的四氯化碳溶液反应 | |
| C. | 乙烯与水生成乙醇的反应 | |
| D. | 在苯中滴入溴水,水层褪色;乙烯与溴水反应 |
1.铜跟稀硝酸反应,如果有1mol硝酸被还原了,则被氧化的铜的物质的量为( )
| A. | $\frac{3}{8}$ mol | B. | $\frac{8}{3}$ mol | C. | $\frac{2}{3}$ mol | D. | $\frac{3}{2}$ mol |
19.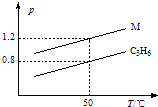 图中两条曲线分别表示1g C3H6、1g M气体在相同体积的容器中压强和温度的关系,试据图形判断M气体可能是( )
图中两条曲线分别表示1g C3H6、1g M气体在相同体积的容器中压强和温度的关系,试据图形判断M气体可能是( )
 图中两条曲线分别表示1g C3H6、1g M气体在相同体积的容器中压强和温度的关系,试据图形判断M气体可能是( )
图中两条曲线分别表示1g C3H6、1g M气体在相同体积的容器中压强和温度的关系,试据图形判断M气体可能是( )| A. | SO2 | B. | CO2 | C. | C3H8 | D. | CO和N2 |
18.关于硝酸的说法正确的是( )
| A. | 硝酸电离出的H+离子,能被Zn、Fe等金属还原成H2 | |
| B. | 浓HNO3与浓HCl按3:1的体积比所得的混合物叫王水 | |
| C. | 硝酸与金属反应时,主要是+5价的氮元素得电子 | |
| D. | 常温下,向浓HNO3中投入Fe片,会产生大量的红棕色气体 |
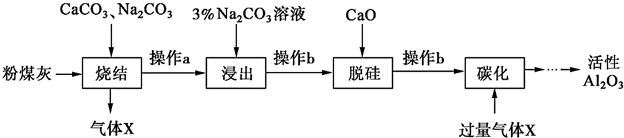
17.我市某地的煤矸石经预处理后含SiO2(63%)、Al2O3(25%)、Fe2O3(5%)及少量钙镁的化合物等,一种综合利用工艺设计如下:

已知:
请回答下列问题:
(1)“酸浸”后得到的残渣中主要含有的物质是SiO2.物质X的化学式为CO2.
(2)“酸浸”时影响铝浸出率的因素可能有(写出两个)盐酸的浓度、反应温度.
(3)为了获得产品Al(OH)3,从煤矸石的盐酸浸取液开始,若只用CaCO3一种试剂,后续操作过程是加入CaCO3调节溶液pH至3.2,过滤洗涤除去Fe(OH)3后,再继续加入CaCO3调节溶液pH到5.4,过滤洗涤得到Al(OH)3.
(4)Al(OH)3可添加到塑料中作阻燃剂的原因是Al(OH)3分解时吸收大量热量且分解生成高熔点的Al2O3.
(5)以Al和MnO2为电极,与NaCl和稀氨水电解质溶液组成一种新型电池,放电时MnO2转化为MnO(OH).该电池反应的化学方程式是Al+3MnO2+3H2O=3MnO(OH)+Al(OH)3.
(6)预处理后的100t煤矸石经上述流程后,得到39t纯度为95%的氢氧化铝产品.则预处理后的100t煤矸石中铝元素的回收率为96.9%.
0 168898 168906 168912 168916 168922 168924 168928 168934 168936 168942 168948 168952 168954 168958 168964 168966 168972 168976 168978 168982 168984 168988 168990 168992 168993 168994 168996 168997 168998 169000 169002 169006 169008 169012 169014 169018 169024 169026 169032 169036 169038 169042 169048 169054 169056 169062 169066 169068 169074 169078 169084 169092 203614

已知:
| 离子 | 开始沉淀pH | 完全沉淀pH |
| Fe3+ | 2.1 | 3.2 |
| Al3+ | 4.1 | 5.4 |
(1)“酸浸”后得到的残渣中主要含有的物质是SiO2.物质X的化学式为CO2.
(2)“酸浸”时影响铝浸出率的因素可能有(写出两个)盐酸的浓度、反应温度.
(3)为了获得产品Al(OH)3,从煤矸石的盐酸浸取液开始,若只用CaCO3一种试剂,后续操作过程是加入CaCO3调节溶液pH至3.2,过滤洗涤除去Fe(OH)3后,再继续加入CaCO3调节溶液pH到5.4,过滤洗涤得到Al(OH)3.
(4)Al(OH)3可添加到塑料中作阻燃剂的原因是Al(OH)3分解时吸收大量热量且分解生成高熔点的Al2O3.
(5)以Al和MnO2为电极,与NaCl和稀氨水电解质溶液组成一种新型电池,放电时MnO2转化为MnO(OH).该电池反应的化学方程式是Al+3MnO2+3H2O=3MnO(OH)+Al(OH)3.
(6)预处理后的100t煤矸石经上述流程后,得到39t纯度为95%的氢氧化铝产品.则预处理后的100t煤矸石中铝元素的回收率为96.9%.


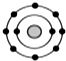
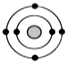
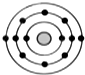
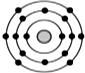
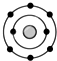 某元素原子的核外电子排布示意图如图所示,下列原子中,与该元素原子的化学性质相似的是( )
某元素原子的核外电子排布示意图如图所示,下列原子中,与该元素原子的化学性质相似的是( )