13.卤代烃与金属镁在无水乙醚中反应,可得格氏试剂R-MgX,它可与醛、酮等羰基化合物加成: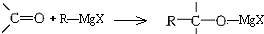 ,所得产物经水解可以得到醇,这是某些复杂醇的合成方法之一.现欲合成(CH3)3C-OH,下列所选用的卤代烃和羰基化合物的组合正确的是( )
,所得产物经水解可以得到醇,这是某些复杂醇的合成方法之一.现欲合成(CH3)3C-OH,下列所选用的卤代烃和羰基化合物的组合正确的是( )
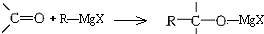 ,所得产物经水解可以得到醇,这是某些复杂醇的合成方法之一.现欲合成(CH3)3C-OH,下列所选用的卤代烃和羰基化合物的组合正确的是( )
,所得产物经水解可以得到醇,这是某些复杂醇的合成方法之一.现欲合成(CH3)3C-OH,下列所选用的卤代烃和羰基化合物的组合正确的是( )| A. | 乙醛和氯乙烷 | B. | 甲醛和1-溴丙烷 | C. | 甲醛和2-溴丙烷 | D. | 丙酮和一氯甲烷 |
12.下列说法正确的是( )
| A. | 同温同压下,H2+Cl2=2HCl在光照和点燃条件的△H不同 | |
| B. | 铅蓄电池在放电过程中,负极质量减小,正极质量增加 | |
| C. | 天然气、沼气和水煤气分别属于化石能源、可再生能源和一级能源 | |
| D. | 元素原子的核外电子排布呈周期性变化是元素性质呈现周期性变化的根本原因 |
11.下列化学用语正确的是( )
| A. | 硫原子的原子结构示意图: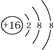 | |
| B. | 过氧化钠的电子式: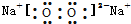 | |
| C. | 原子核内有8个质子、10个中子的氧原子:810O | |
| D. | HClO的结构式为 H-Cl-O |
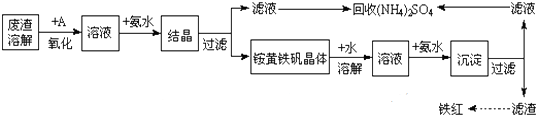
9.草酸镍晶体(NiC2O4•2H2O)可用于制镍催化剂,某小组用废镍催化剂(成分为Al2O3、Ni、Fe、SiO2、CaO等)制备草酸镍晶体的部分实验流程如下:

已知:①Ksp(CaF2)=1.46×10-10,Ksp(CaC2O4)=2.34×10-9.
②相关金属离子生成氢氧化物沉淀的pH如下表(开始沉淀的pH按金属离子浓度为1,.0mol•L-1计算).
(1)“粉碎”的目的是增大接触面积,加快反应速率;提高镍的浸出率.
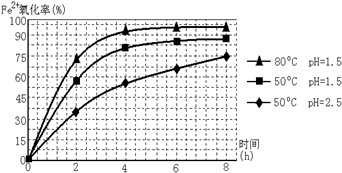
(2)保持其他条件相同,在不同温度下对废镍催化剂进行“酸浸”,镍浸出率随时间变化如图.“酸浸”的适宜温度与时间分别为c(填字母).
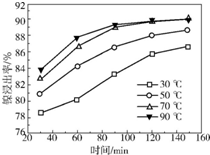
a.30℃、30min b.90℃、150min c.70℃、120min d.90℃、120min
(3)证明“沉镍”工序中Ni2+已经沉淀完全的实验步骤及现象是静置,在上层清液中继续滴加(NH4)2C2O4溶液,若不再产生沉淀,则“沉镍”工序已经完成.将“沉镍”工序得到的混合物过滤,所得固体用75%乙醇溶液洗涤、110℃下烘干,得草酸镍晶体.用75%乙醇溶液洗涤的目的是洗去(NH4)2SO4杂质、便于烘干、减少草酸镍晶体损失.
(4)在除铁和铝工序中,应先加入H2O2氧化,再加氢氧化镍调节pH值的范围为5.0≤pH<6.7.第2步中加入适量NH4F溶液的作用是除去杂质Ca2+.
(5)将得到的草酸镍晶体在真空中加热至320℃分解可重新制得单质镍催化剂,写出该制备过程的化学方程式:NiC2O4•2H2O$\frac{\underline{\;320℃\;}}{\;}$Ni+2CO2↑+2H2O.
(6)已知废镍催化剂中镍的质量分数为5.9%,则100kg废镍催化剂最多可制得18.3kg草酸镍晶体(Ni:59,C:12,H:1,O:16).

已知:①Ksp(CaF2)=1.46×10-10,Ksp(CaC2O4)=2.34×10-9.
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Al3+ | 3.0 | 5.0 |
| Ni2+ | 6.7 | 9.5 |
(1)“粉碎”的目的是增大接触面积,加快反应速率;提高镍的浸出率.
(2)保持其他条件相同,在不同温度下对废镍催化剂进行“酸浸”,镍浸出率随时间变化如图.“酸浸”的适宜温度与时间分别为c(填字母).

a.30℃、30min b.90℃、150min c.70℃、120min d.90℃、120min
(3)证明“沉镍”工序中Ni2+已经沉淀完全的实验步骤及现象是静置,在上层清液中继续滴加(NH4)2C2O4溶液,若不再产生沉淀,则“沉镍”工序已经完成.将“沉镍”工序得到的混合物过滤,所得固体用75%乙醇溶液洗涤、110℃下烘干,得草酸镍晶体.用75%乙醇溶液洗涤的目的是洗去(NH4)2SO4杂质、便于烘干、减少草酸镍晶体损失.
(4)在除铁和铝工序中,应先加入H2O2氧化,再加氢氧化镍调节pH值的范围为5.0≤pH<6.7.第2步中加入适量NH4F溶液的作用是除去杂质Ca2+.
(5)将得到的草酸镍晶体在真空中加热至320℃分解可重新制得单质镍催化剂,写出该制备过程的化学方程式:NiC2O4•2H2O$\frac{\underline{\;320℃\;}}{\;}$Ni+2CO2↑+2H2O.
(6)已知废镍催化剂中镍的质量分数为5.9%,则100kg废镍催化剂最多可制得18.3kg草酸镍晶体(Ni:59,C:12,H:1,O:16).
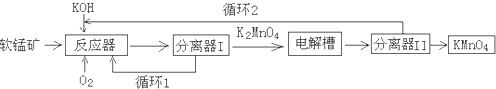
7.为回收利用废钒催化剂(含有V2O5、VOSO4及不溶性残渣),科研人员最新研制了一种离子交换法回收钒的新工艺,主要流程如下:
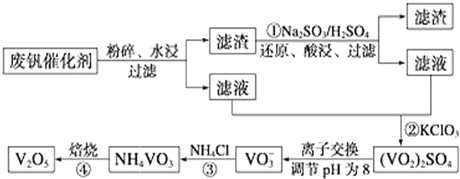
部分含钒物质在水中的溶解性如下:
回答下列问题:
(1)工业由V2O5冶炼金属钒常用铝热剂法,写出该反应的化学方程式3V2O5+10Al$\frac{\underline{\;高温\;}}{\;}$5Al2O3+6V.
(2)图中所示滤液中含钒的主要成分为VOSO4(写化学式).
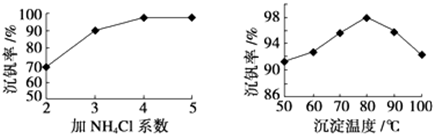
(3)该工艺中反应③的沉淀率(又称沉钒率)是回收钒的关键之一,该步反应的离子方程式NH4++VO3-=NH4VO3↓;沉钒率的高低除受溶液pH影响外,还需要控制氯化铵系数(NH4Cl加入质量与料液中V2O5的质量比)和温度.根据下图判断最佳控制氯化铵系数和温度为4、80℃.
(4)用硫酸酸化的H2C2O4溶液滴定(VO2)2SO4溶液,以测定反应②后溶液中含钒量,完成反应的离子方程式:
□VO2+□H2C2O4+□H+═□VO2++□CO2↑+□H2O.
(5)全矾液流电池的电解质溶液为VOSO4溶液,电池的工作原理为V${{O}_{2}}^{+}$+V2++2H+$?_{充电}^{放电}$VO2++H2O+V3+,电池充电时阳极的电极反应式为VO2++H2O-e-=VO2++2H+.

部分含钒物质在水中的溶解性如下:
| 物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
| 溶解性 | 可溶 | 难溶 | 难溶 | 易溶 |
(1)工业由V2O5冶炼金属钒常用铝热剂法,写出该反应的化学方程式3V2O5+10Al$\frac{\underline{\;高温\;}}{\;}$5Al2O3+6V.
(2)图中所示滤液中含钒的主要成分为VOSO4(写化学式).
(3)该工艺中反应③的沉淀率(又称沉钒率)是回收钒的关键之一,该步反应的离子方程式NH4++VO3-=NH4VO3↓;沉钒率的高低除受溶液pH影响外,还需要控制氯化铵系数(NH4Cl加入质量与料液中V2O5的质量比)和温度.根据下图判断最佳控制氯化铵系数和温度为4、80℃.

(4)用硫酸酸化的H2C2O4溶液滴定(VO2)2SO4溶液,以测定反应②后溶液中含钒量,完成反应的离子方程式:
□VO2+□H2C2O4+□H+═□VO2++□CO2↑+□H2O.
(5)全矾液流电池的电解质溶液为VOSO4溶液,电池的工作原理为V${{O}_{2}}^{+}$+V2++2H+$?_{充电}^{放电}$VO2++H2O+V3+,电池充电时阳极的电极反应式为VO2++H2O-e-=VO2++2H+.
4.CoCl2•6H2O是制备钴酸锂电池用四氧化三钴粉末的主要原料,工业上利用水钴矿(主要成分为Co2O3、Fe2O3、FeO、Al2O3等)制取CoCl2•6H2O的简化工艺流程如图所示:
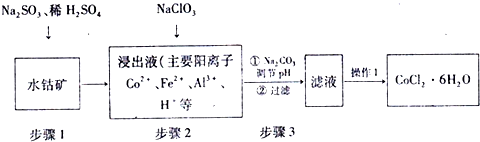
(1)步骤1中三价钴转变为二价钴的离子反应方程式为:Co2O3+SO32-+4H+=2Co2++SO42-+2H2O.
(2)步骤2中加入的NaClO3目的是将Fe2+氧化成Fe3+,方便利用水解除去铁离子,同时为溶液提供氯离子.
(3)部分金属阳离子以氢氧化物形式沉淀时的pH情况如下:
步骤3中加入Na2CO3目的是除去铁和铝元素,其之所以可以除去铁和铝元素的原因是CO32-与H+反应消耗H+,促使Fe3+、Al3+水解平衡右移,生成Fe(OH)3、Al(OH)3沉淀而将其除去.理论上,此步pH应该控制的范围是5.4≤PH<7.6.
(4)操作1包括以下基本实验操作,它们是蒸发浓缩、冷却结晶和过滤、洗涤、风干.
(5)已知:Ag++SCN-=AgSCN↓,为测定粗品中CoCl2•6H2O的含量,称取11.9克粗品溶于水配成100mL溶液,从中取出25.00mL,先加入含AgNO30.03mol的溶液(杂质不反应),过量的AgNO3用0.50mol•L-1的KSCN溶液滴定,该滴定所用指示剂为Fe(NO3)3;若消耗KSCN溶液20.00mL则该粗品中CoCl2•6H2O的质量含量为80%.
0 168873 168881 168887 168891 168897 168899 168903 168909 168911 168917 168923 168927 168929 168933 168939 168941 168947 168951 168953 168957 168959 168963 168965 168967 168968 168969 168971 168972 168973 168975 168977 168981 168983 168987 168989 168993 168999 169001 169007 169011 169013 169017 169023 169029 169031 169037 169041 169043 169049 169053 169059 169067 203614

(1)步骤1中三价钴转变为二价钴的离子反应方程式为:Co2O3+SO32-+4H+=2Co2++SO42-+2H2O.
(2)步骤2中加入的NaClO3目的是将Fe2+氧化成Fe3+,方便利用水解除去铁离子,同时为溶液提供氯离子.
(3)部分金属阳离子以氢氧化物形式沉淀时的pH情况如下:
| 金属阳离子 | Fe3+ | Al3+ | Fe2+ | Co2+ |
| 开始沉淀的pH | 2.2 | 4.1 | 7.5 | 7.6 |
| 沉淀完全的pH | 3.5 | 5.4 | 9.5 | 9.2 |
(4)操作1包括以下基本实验操作,它们是蒸发浓缩、冷却结晶和过滤、洗涤、风干.
(5)已知:Ag++SCN-=AgSCN↓,为测定粗品中CoCl2•6H2O的含量,称取11.9克粗品溶于水配成100mL溶液,从中取出25.00mL,先加入含AgNO30.03mol的溶液(杂质不反应),过量的AgNO3用0.50mol•L-1的KSCN溶液滴定,该滴定所用指示剂为Fe(NO3)3;若消耗KSCN溶液20.00mL则该粗品中CoCl2•6H2O的质量含量为80%.
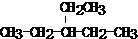 .
.