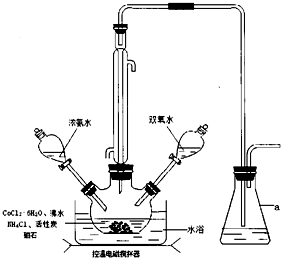
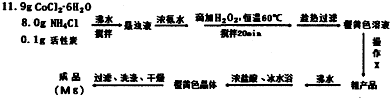
题目内容
5.向一容积为5L的密闭容器中充入NH3和O2,它们的物质的量之比为1:2,发生如下反应:4NH3+O2?4NO+6H2O(g).(1)上述反应在一定条件下2min后该反应的自由能△G=△H-T△S=0,此时该反应达到平衡状态,此时NH3为2mol,NH3的转化率为20%.以NO的浓度变化表示该反应的平均反应速率为0.25mol•L-1•min-1,O2的平衡浓度为0.875mol•L-1 .
(2)在达到平衡后,充入相当于原组成气体1倍的惰性气体.如果容器的体积不变,平衡不移动.
分析 (1)△G=△H-T△S=0,说明此反应达到平衡状态,利用三段法计算平衡反应速率以及平衡浓度;
(2)容积不变通入惰性气体,因为浓度不变,平衡不移动.
解答 解:(1)△G=△H-T△S=0,说明反应达到平衡状态;
设充入NH3为xmol,
4NH3(g)+5O2(g)?4NO(g)+6H2O(g)
加入量 x 2x 0 0
反应量 0.2x 0.25x 0.2x 0.3x
平衡量 2 2x-0.25x 0.2x 0.3x
2min后达到平衡,NH3为2mol,NH3的转化率为20%,
x-0.2x=2,解得x=2.5,用NO的浓度变化表示该反应的平均反应速率为$\frac{\frac{0.2×2.5mol}{5L}}{2min}$=0.25mol•L-1•min-1,
O2的平衡浓度为$\frac{2×2.5mol-0.25×2.5mol}{5L}$=0.875mol•L-1,故答案为:平衡;0.25mol•L-1•min-1;0.875mol•L-1 ;
(2)容积不变通入惰性气体,因为浓度不变,平衡不移动,故答案为:不.
点评 本题主要考查的是化学平衡状态的判断.化学反应速率的计算以及平衡是否移动的判断等,三段法为解决此类题目的常用方法,难度不大.

练习册系列答案
相关题目
11.下列电离方程式中,正确的是( )
| A. | CH3COOH=CH3COO-+H+ | B. | NaOH=Na++OH- | ||
| C. | NH4Cl?NH4++Cl- | D. | NaHCO3=Na++H++CO32-. |
12.下列反应的离子方程式书写不正确的是( )
| A. | Ba(OH)2溶液与CuSO4溶液反应:Ba2++SO42-=BaSO4↓ | |
| B. | NaOH溶液与稀硫酸的反应:OH-+H+=H2O | |
| C. | NaHCO3溶液与盐酸的反应:HCO3-+H+=H2O+CO2↑ | |
| D. | KCl溶液与AgNO3溶液的反应:Cl-+Ag+=AgCl↓ |
9.下列有关实验操作错误的是( )
| A. | 用药匙取用粉末状或颗粒状固体 | B. | 用胶头滴管滴加少量液体 | ||
| C. | 倾倒液体时试剂瓶标签面向手心 | D. | 给盛有$\frac{2}{3}$体积液体的试管加热 |
16.在一定条件下,既能发生酯化反应,又能发生消去反应的是( )
| A. | CH3CH2OH | B. | CH3OH | C. | CH3CHO | D. | CH3COOH |
 .
.