题目内容
12.下列说法正确的是( )| A. | 同温同压下,H2+Cl2=2HCl在光照和点燃条件的△H不同 | |
| B. | 铅蓄电池在放电过程中,负极质量减小,正极质量增加 | |
| C. | 天然气、沼气和水煤气分别属于化石能源、可再生能源和一级能源 | |
| D. | 元素原子的核外电子排布呈周期性变化是元素性质呈现周期性变化的根本原因 |
分析 A.根据△H=生成物的焓-反应物的焓可知,焓变与反应条件无关;
B.根据铅蓄电池的工作原理来回答;
C.天然气是由古代生物在地下发生复杂的变化形成的,沼气是由植物秸秆发酵形成的,水煤气是由C与水蒸气反应生成的;
D.随原子序数的递增,电子层数和最外层电子数都呈现周期性的变化而引起元素性质的周期性变化.
解答 解:A、根据△H=生成物的焓-反应物的焓可知,焓变与反应条件无关,所以在光照和点燃条件下该反应的△H相同,故A错误;
B、铅蓄电池工作时,负极是金属铅失电子,正极上是二氧化铅得电子,都是生成硫酸铅,质量都增加,故B错误;
C、沼气是由植物秸秆发酵形成的属于可再生能源;天然气是由古代生物在地下发生复杂的变化形成的,属于化石能源;水煤气是由C与水蒸气在高温条件下反应生成的属于二次能源,故C错误;
D、原子结构中核外电子排布的周期性变化而引起元素的性质呈周期性变化,故D正确;
故选D.
点评 本题综合考查化学反应中能量的变化、能源类别、原子结构中核外电子排布的周期性变化原因分析以及原电池的工作原理知识,难度不大.

练习册系列答案
 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案
相关题目
18.几种短周期元素的原子半径及主要化合价如表,下列说法正确的是( )
| 元素代号 | X | Y | Z | M | R | Q | |
| 原子半径(×10-10 m) | 1.86 | 0.99 | 1.43 | 1.60 | 0.75 | 0.74 | |
| 主要化合价 | 最高正价 | +1 | +7 | +3 | +2 | +5 | - |
| 最低负价 | - | -1 | - | - | -3 | -2 | |
| A. | 元素X和Q形成的化合物中不可能含有共价键 | |
| B. | X、Z、R的最高价氧化物的水化物之间可两两相互反应 | |
| C. | Q2-比R3-更容易失去电子 | |
| D. | M(OH)2的碱性比XOH的碱性强 |
19.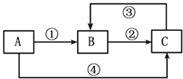 A、B、C三种物质中均含有同一种元素M,它们之间有如下图所示的转化关系(部分反应物质已略去).A为一种金属单质,反应①②③均为化合反应,反应④为置换反应.下列有关说法不正确的是( )
A、B、C三种物质中均含有同一种元素M,它们之间有如下图所示的转化关系(部分反应物质已略去).A为一种金属单质,反应①②③均为化合反应,反应④为置换反应.下列有关说法不正确的是( )
 A、B、C三种物质中均含有同一种元素M,它们之间有如下图所示的转化关系(部分反应物质已略去).A为一种金属单质,反应①②③均为化合反应,反应④为置换反应.下列有关说法不正确的是( )
A、B、C三种物质中均含有同一种元素M,它们之间有如下图所示的转化关系(部分反应物质已略去).A为一种金属单质,反应①②③均为化合反应,反应④为置换反应.下列有关说法不正确的是( )| A. | ①中所加试剂可能是氯气 | |
| B. | ③中需要加具有氧化性的试剂 | |
| C. | A与稀硝酸反应一定能实现元素M在①中发生的价态变化 | |
| D. | 元素M在②中发生的价态变化也能通过加碘化钾溶液实现 |
16.在一定条件下,既能发生酯化反应,又能发生消去反应的是( )
| A. | CH3CH2OH | B. | CH3OH | C. | CH3CHO | D. | CH3COOH |
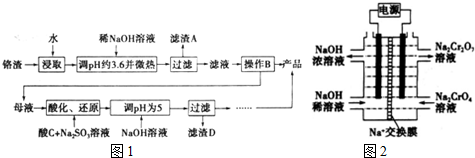
7.为回收利用废钒催化剂(含有V2O5、VOSO4及不溶性残渣),科研人员最新研制了一种离子交换法回收钒的新工艺,主要流程如下:

部分含钒物质在水中的溶解性如下:
回答下列问题:
(1)工业由V2O5冶炼金属钒常用铝热剂法,写出该反应的化学方程式3V2O5+10Al$\frac{\underline{\;高温\;}}{\;}$5Al2O3+6V.
(2)图中所示滤液中含钒的主要成分为VOSO4(写化学式).
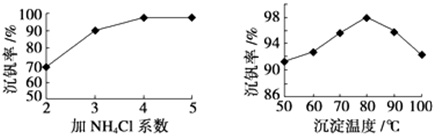
(3)该工艺中反应③的沉淀率(又称沉钒率)是回收钒的关键之一,该步反应的离子方程式NH4++VO3-=NH4VO3↓;沉钒率的高低除受溶液pH影响外,还需要控制氯化铵系数(NH4Cl加入质量与料液中V2O5的质量比)和温度.根据下图判断最佳控制氯化铵系数和温度为4、80℃.
(4)用硫酸酸化的H2C2O4溶液滴定(VO2)2SO4溶液,以测定反应②后溶液中含钒量,完成反应的离子方程式:
□VO2+□H2C2O4+□H+═□VO2++□CO2↑+□H2O.
(5)全矾液流电池的电解质溶液为VOSO4溶液,电池的工作原理为V${{O}_{2}}^{+}$+V2++2H+$?_{充电}^{放电}$VO2++H2O+V3+,电池充电时阳极的电极反应式为VO2++H2O-e-=VO2++2H+.

部分含钒物质在水中的溶解性如下:
| 物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
| 溶解性 | 可溶 | 难溶 | 难溶 | 易溶 |
(1)工业由V2O5冶炼金属钒常用铝热剂法,写出该反应的化学方程式3V2O5+10Al$\frac{\underline{\;高温\;}}{\;}$5Al2O3+6V.
(2)图中所示滤液中含钒的主要成分为VOSO4(写化学式).
(3)该工艺中反应③的沉淀率(又称沉钒率)是回收钒的关键之一,该步反应的离子方程式NH4++VO3-=NH4VO3↓;沉钒率的高低除受溶液pH影响外,还需要控制氯化铵系数(NH4Cl加入质量与料液中V2O5的质量比)和温度.根据下图判断最佳控制氯化铵系数和温度为4、80℃.

(4)用硫酸酸化的H2C2O4溶液滴定(VO2)2SO4溶液,以测定反应②后溶液中含钒量,完成反应的离子方程式:
□VO2+□H2C2O4+□H+═□VO2++□CO2↑+□H2O.
(5)全矾液流电池的电解质溶液为VOSO4溶液,电池的工作原理为V${{O}_{2}}^{+}$+V2++2H+$?_{充电}^{放电}$VO2++H2O+V3+,电池充电时阳极的电极反应式为VO2++H2O-e-=VO2++2H+.
1.元素A的单质及A与B形成的化合物能按如图所示的关系发生转化.则下列说法正确的是( )
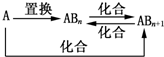

| A. | 图中物质间的转化都不是氧化还原反应 | |
| B. | 当n=1时,A可能是N2 | |
| C. | A一定是金属元素 | |
| D. | 当n=2时,A可能是Fe |
2.一定温度下,反应N2(g)+3H2(g)?2NH3(g)达到化学平衡状态的标志( )
| A. | N2、H2和NH3的质量分数不再改变 | |
| B. | c(N2):c(H2):c(NH3)=1:3:2 | |
| C. | N2与H2的物质的量之和是NH3的物质的量2 | |
| D. | 单位时间里每增加1 mol N2,同时增加3 mol H2 |