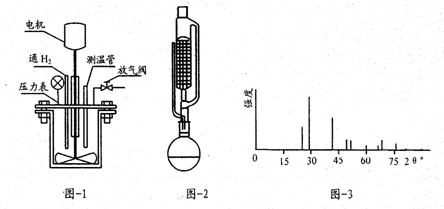
7.银锌电池是广泛用做各种电子仪器的电源,其放电过程可表示为Ag2O+Zn=ZnO+2Ag,此电池放电时,有关说法正确的是( )
| A. | 电能转化为化学能 | B. | 电解质溶液是稀硫酸 | ||
| C. | 电子通过外电路从正极流向负极 | D. | Zn做负极被氧化 |
6.下列关于有机物  的说法中不正确的是( )
的说法中不正确的是( )
 的说法中不正确的是( )
的说法中不正确的是( )| A. | 所有的碳原子在同一个平面上 | B. | 能发生水解但不能发生消去反应 | ||
| C. | 能与AgNO3溶液生成浅黄色沉淀 | D. | 能够发生加成反应 |
5.下列每组中各有两对物质,它们都能用分液漏斗分离的是( )
| A. | 乙酸乙酯和水、酒精和水 | B. | 四氯化碳和水、苯和液溴 | ||
| C. | 硝基苯和水、乙酸和水 | D. | 苯和水、己烷和水 |
2.25℃时,水的电离达到平衡:H2O?H++OH-;△H>0,下列叙述正确的是( )
0 168865 168873 168879 168883 168889 168891 168895 168901 168903 168909 168915 168919 168921 168925 168931 168933 168939 168943 168945 168949 168951 168955 168957 168959 168960 168961 168963 168964 168965 168967 168969 168973 168975 168979 168981 168985 168991 168993 168999 169003 169005 169009 169015 169021 169023 169029 169033 169035 169041 169045 169051 169059 203614
| A. | 向水中加入NaOH溶液,平衡逆向移动,c(OH-)降低 | |
| B. | 向水中加入少量固体NaHSO4,c(H+)增大,Kw不变 | |
| C. | 向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低? | |
| D. | 将水加热,Kw增大,pH变小 |
 一定温度下在体积为5L的密闭容器中发生可逆反应.
一定温度下在体积为5L的密闭容器中发生可逆反应.