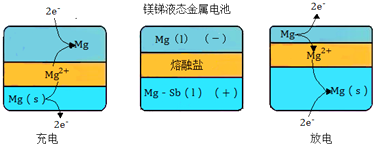
题目内容
7.银锌电池是广泛用做各种电子仪器的电源,其放电过程可表示为Ag2O+Zn=ZnO+2Ag,此电池放电时,有关说法正确的是( )| A. | 电能转化为化学能 | B. | 电解质溶液是稀硫酸 | ||
| C. | 电子通过外电路从正极流向负极 | D. | Zn做负极被氧化 |
分析 根据电池反应式知,Ag元素化合价由+1价变为0价、Zn元素化合价由0价变为+2价,所以Zn是负极、Ag是正极,电子从负极沿导线流向正极,据此分析解答.
解答 解:A.该装置是原电池,是将化学能转化为电能的装置,故A错误;
B.电解质溶液不能是稀硫酸,稀硫酸和氧化银反应生成硫酸银沉淀而得不到Ag,故B错误;
C.电子从负极Zn沿导线流向正极Ag,故C错误;
D.根据电池反应式知,Zn元素化合价由0价变为+2价,所以Zn是负极,发生氧化反应而被氧化,故D正确;
故选D.
点评 本题考查化学电源新型电池,正确判断正负极是解本题关键,明确正负极的判断方法、电子流向及反应类型即可解答,注意电极反应式的书写.

练习册系列答案
 互动英语系列答案
互动英语系列答案 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案
相关题目
18.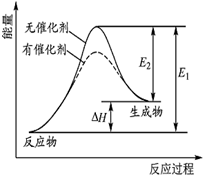 某反应的反应过程中能量变化如图 (E1表示正反应的活化能,E2表示逆反应的活化能).下列有关叙述不正确的是( )
某反应的反应过程中能量变化如图 (E1表示正反应的活化能,E2表示逆反应的活化能).下列有关叙述不正确的是( )
 某反应的反应过程中能量变化如图 (E1表示正反应的活化能,E2表示逆反应的活化能).下列有关叙述不正确的是( )
某反应的反应过程中能量变化如图 (E1表示正反应的活化能,E2表示逆反应的活化能).下列有关叙述不正确的是( )| A. | 该反应为吸热反应 | |
| B. | 催化剂不能改变反应的焓变 | |
| C. | 催化剂不能降低反应的活化能 | |
| D. | 逆反应的活化能小于正反应的活化能 |
15.已知元素砷(As)的原子序数为33,与N元素同主族,下列叙述正确的是( )
| A. | 砷元素的最高化合价为+3 | |
| B. | 砷的气态氢化物比NH3稳定 | |
| C. | 砷的最高价氧化物的水溶液呈强碱性 | |
| D. | 砷原子的第3电子层含有18个电子 |
2.25℃时,水的电离达到平衡:H2O?H++OH-;△H>0,下列叙述正确的是( )
| A. | 向水中加入NaOH溶液,平衡逆向移动,c(OH-)降低 | |
| B. | 向水中加入少量固体NaHSO4,c(H+)增大,Kw不变 | |
| C. | 向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低? | |
| D. | 将水加热,Kw增大,pH变小 |
12.下列说法中,正确的是( )
| A. | 将某种稀酸溶液,用蒸馏水稀释10倍,其pH一定增大一个单位 | |
| B. | 100℃时的NaCl溶液,PH约为6时呈中性. | |
| C. | pH相同的醋酸和H2SO4分别能恰好中和等物质的量的NaOH | |
| D. | 将0.1mol/L CH3COOH溶液加水稀释10倍,溶液中所有离子的浓度均减小 |
19.如表所示的五种元素中,W、X、Y、Z为短周期元素,这四种元素的原子最外层电子数之和为22.下列说法正确的是( )
| X | Y | ||
| W | Z | ||
| T |
| A. | W、X、Y三种元素最低价氢化物的稳定性依次降低 | |
| B. | X、Z、W的最高价氧化物对应的水化物酸性最强的是X | |
| C. | 五种元素均为非金属元素 | |
| D. | T元素的单质具有半导体的特性,T与Z元素可形成化合物TZ4 |
16.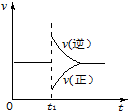 可逆反应2SO2(g)+O2(g)═2SO3(g)△H<0一定条件下在某密闭容器中达到平衡.t1时改变某一条件,化学反应速率与反应时间关系如图.下列说法中正确的是( )
可逆反应2SO2(g)+O2(g)═2SO3(g)△H<0一定条件下在某密闭容器中达到平衡.t1时改变某一条件,化学反应速率与反应时间关系如图.下列说法中正确的是( )
 可逆反应2SO2(g)+O2(g)═2SO3(g)△H<0一定条件下在某密闭容器中达到平衡.t1时改变某一条件,化学反应速率与反应时间关系如图.下列说法中正确的是( )
可逆反应2SO2(g)+O2(g)═2SO3(g)△H<0一定条件下在某密闭容器中达到平衡.t1时改变某一条件,化学反应速率与反应时间关系如图.下列说法中正确的是( )| A. | t1时改变某一条件,平衡将向逆反应方向移动 | |
| B. | 维持压强不变,t1时升高反应体系温度 | |
| C. | 维持温度不变,t1时扩大反应体系体积 | |
| D. | 维持温度、压强不变,t1时充入SO2(g) |