题目内容
9. 一定温度下在体积为5L的密闭容器中发生可逆反应.
一定温度下在体积为5L的密闭容器中发生可逆反应.(I)若某可逆反应的化学平衡常数表达式为K=$\frac{c(CO)•c({H}_{2})}{c({H}_{2}O)}$,写出该反应的化学方程式C(s)+H2O(g)?CO(g)+H2(g).
(Ⅱ)若该密闭容器中加人的是2molFe(a)与1molH2O(g)发生3Fe(s)+4H2O(g)?Fe3O4(s)+4H2O(g)△H<0 t1秒时,H2的物质的量为0.20mol,到第t2称时恰好达到平衡.此时H2的物质的量为0.35mol.
(1)t1-t2这段时间内的化学反应速率v(H2)=$\frac{0.03}{({t}_{2}-{t}_{1})}$mol•L-1•s-1.
(2)若继续加人2molFe(s),则平衡不移动(填“向正反应方向”、“向逆反应方向”或“不”).
(3)该反应的逆反应速率随时间变化的关系如图.t3时改变了某种条件,改变的条件是升高了温度或增大了H2的浓度.
分析 (I)根据平衡常数的定义,生成物浓度的幂之积与反应物浓度的幂之积之比为平衡常数;
(Ⅱ)(1)根据反应速率的计算公式,求v(H2)即可;
(2)加入Fe后,Fe是固体,平衡不移动;
(3)如右图t3时刻,反应速率突然增大,可能是温度或者浓度的变化.
解答 解:(Ⅰ)根据平衡常数的定义,生成物浓度的幂之积与反应物浓度的幂之积之比为平衡常数,所以方程式为:C(s)+H2O(g)?CO(g)+H2 (g),
故答案为:C(s)+H2O(g)?CO(g)+H2 (g);
(Ⅱ)(1)根据反应速率的计算公式,v(H2)=$\frac{0.03}{({t}_{2}-{t}_{1})}$ mol•L-1•s-1.故答案为:$\frac{0.03}{({t}_{2}-{t}_{1})}$ mol•L-1•s-1
(2)加入Fe后,Fe是固体,平衡不移动;故答案为:不;
(3)如右图t3时刻,逆反应反应速率突然增大,而后逆反应速率减小,反应向逆反应方向进行,可能是增大氢气浓度,正反应为放热反应,也可能是升高温度,
故答案为:升高了温度或增大了H2的浓度.
点评 本题是一道化学反应速率与平衡的综合题,考查了平衡常数的含义和化学反应速率的计算,综合性强,难度较大.

练习册系列答案
相关题目
19.分子式为C3H8O的醇与C4H8O2的羧酸浓H2SO4存在时共热生成的酯有( )
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
20.苹果酸的结构简式为 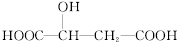 ,下列说法正确的是( )
,下列说法正确的是( )
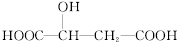 ,下列说法正确的是( )
,下列说法正确的是( )| A. | 1mol苹果酸可与3 mol NaOH发生中和反应 | |
| B. | 1mol苹果酸与足量金属Na反应生成1mol H2 | |
| C. | 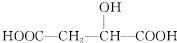 与苹果酸互为同分异构体 与苹果酸互为同分异构体 | |
| D. | 苹果酸中能发生酯化反应的官能团有2种 |
17.未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且有些可以再生.下列属于最有希望的新能源的是( )
①天然气 ②煤 ③核能 ④太阳能 ⑤生物质能 ⑥风能 ⑦氢能.
①天然气 ②煤 ③核能 ④太阳能 ⑤生物质能 ⑥风能 ⑦氢能.
| A. | ①②③④ | B. | ②⑤⑥⑦ | C. | ①③④⑤⑥ | D. | 除①②外 |
14.下列说法正确的是( )
| A. | 所有放热反应均是自发反应,也是熵增大的反应 | |
| B. | 向AgCl固液混合物中滴入KI饱和溶液,有AgI沉淀生成,说明AgCl的溶解度小于有AgI的溶解度 | |
| C. | 锌与稀硫酸反应制取氢气,加入少量的硫酸铜粉末会使产生氢气的速度减慢 | |
| D. | 用电解法精炼粗铜时,粗铜板作阳极,纯铜板作阴极 |
1.有一无色透明溶液,欲确定是否含有下列离子:K+、Mg2+、Al3+、Fe2+、Ba2+、NO3-、SO42-、Cl-、I-、
HCO3-,取该溶液进行如下实验,下列说法中正确的是( )
HCO3-,取该溶液进行如下实验,下列说法中正确的是( )
| 实验步骤 | 实验现象 |
| ①取少量该溶液,加几滴石蕊溶液 | 溶液变红色 |
| ②取少量该溶液,加入铜片和浓硫酸,加热 | 有无色气体产生,遇空气可以变成红棕色 |
| ③取少量该溶液,加入BaCl2溶液 | 有白色沉淀生成 |
| ④取③中的上层清液,加入AgNO3溶液 | 有稳定的白色沉淀生成,且不溶于稀硝酸 |
| ⑤取少量该溶液,加入NaOH溶液 | 有白色沉淀生成,当NaOH过量时,沉淀部分溶解 |
| A. | 溶液中一定存在的离子是SO42-、Mg2+、Al3+、Cl- | |
| B. | 溶液中一定存在的离子是NO3-、SO42-、Mg2+、Al3+ | |
| C. | 溶液中肯定不存在的离子是Fe2+、HCO3-、I-、SO42- | |
| D. | 溶液中肯定不存在的离子是Fe2+、HCO3-、Mg2+、I-、Ba2+ |
18.下列的实验事实和解释或结论都正确的是( )
| 选项 | 实验事实 | 解释或结论 |
| A | 2N2O5(g)?4NO2(g)+O2(g)△H>0 在室温下能自发进行 | 这是一个熵增的反应 |
| B | 向0.1mol•L-1的氨水中通入少量氨气,溶液的pH减小 | 电离平衡向逆方向移动,溶液中的c(OH-) 减小 |
| C | 锌与稀硫酸反应过程中,开始反应后速率逐渐增大 | 该反应是放热反应 |
| D | 已建立平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动 | 反应物的浓度一定降低 |
| A. | A | B. | B | C. | C | D. | D |
3.工业上回收利用某合金废料(主要含Fe、Cu、Co、Li等,已知Co、Fe都是中等活泼金属)的工艺流程如下:
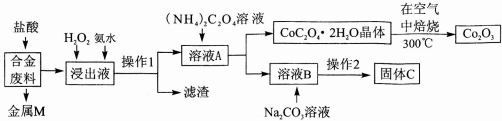
(1)金属M为Cu,操作1为过滤.
(2)加入H2O2的作用是(用离子方程式表示)2Fe2++H2O2+2H+=2Fe3++2H2O,加入氨水的作用是调节溶液的pH使Fe3+转化为Fe(OH)3沉淀.
(3)充分焙烧的化学方程式为4CoC2O4?2H2O+3O2$\frac{\underline{\;焙烧\;}}{\;}$2Co2O3+8 H2O+8CO2.
(4)已知Li2CO3微溶于水,其饱和溶液的浓度与温度关系见下表.操作2中,蒸发浓缩后必须趁热过滤,其原因是减少Li2CO3的溶解损失,90℃时Ksp(Li2CO3)的值为4.0×10-3.
(5)用惰性电极电解熔融Li2CO3制取锂,阳极生成两种气体,则阳极的电极反应式为2CO32--4e-=O2↑+2CO2↑.

(1)金属M为Cu,操作1为过滤.
(2)加入H2O2的作用是(用离子方程式表示)2Fe2++H2O2+2H+=2Fe3++2H2O,加入氨水的作用是调节溶液的pH使Fe3+转化为Fe(OH)3沉淀.
(3)充分焙烧的化学方程式为4CoC2O4?2H2O+3O2$\frac{\underline{\;焙烧\;}}{\;}$2Co2O3+8 H2O+8CO2.
(4)已知Li2CO3微溶于水,其饱和溶液的浓度与温度关系见下表.操作2中,蒸发浓缩后必须趁热过滤,其原因是减少Li2CO3的溶解损失,90℃时Ksp(Li2CO3)的值为4.0×10-3.
| 温度/℃ | 10 | 30 | 60 | 90 |
| 浓度/mol•L-1 | 0.21 | 0.17 | 0.14 | 0.10 |