7.化学与社会、生活密切相关,下列说法正确的是( )
| A. | 聚氯乙烯一次性超薄袋可用于包装食品 | |
| B. | 利用电渗析法和离子交换法能获得纯净水 | |
| C. | 体积分数为95%的酒精用作医用酒精 | |
| D. | 石油裂化的目的是得到乙烯、丙烯等化工原料 |
6.某学习小组利用图1装置进行CO2与饱和Na2CO3溶液反应制备NaHCO3.
(1)选取必要的实验装置,正确的连接顺序为CAB(填序号).
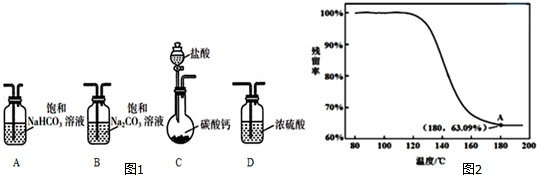
(2)为确定制得的固体样品是纯净的NaHCO3,小组同学提出下列实验方案:
甲方案:将样品溶液与饱和澄清石灰水反应,观察现象.
乙方案:将样品溶液与BaCl2溶液反应,观察现象.
丙方案:测定pH法.
丁方案:热重分析法.
①判定甲方案不可行(填“可行”或“不可行”).
②为判定乙方案的可行性,某同学用纯净的NaHCO3配制的溶液,与BaCl2溶液等体积混合进行实验,结果如下:
(i)此实验已可说明乙方案是不可行的.请结合以下数据,并通过计算说明产生浑浊的原因.
[己知:0.l mol•L-1 NaHCO3溶液电离出的c(CO32-)为0.001l mol•L-1,Ksp(BaCO3)=5.1×10-9]
答:Qc=c(Ba2+)×c(CO32-)=$\frac{0.2}{2}$×0.0011=1.1×10-4>5.1×10-9.
(ii)产生浑浊(伴有气体产生)的离子方程式Ba2++2HCO3-=BaCO3↓+CO2↑+H2O.
③用pH计测定的丙方案如下:
取m克的固体样晶溶解于水配成V mL的溶液,用pH计测pH:
还应补充的实验是:另取等质量的分析纯NaHC03溶于水中配成V mL的溶液,用pH计测pH
④进行丁方案实验,得到固体残留率随温度变化的曲线如图2所示,根据A点坐标得到的结沦是制得的固体样品是纯净的NaHCO3.
(残留率=$\frac{剩余固体的质量}{原始固体的质量}$×100%)
(1)选取必要的实验装置,正确的连接顺序为CAB(填序号).

(2)为确定制得的固体样品是纯净的NaHCO3,小组同学提出下列实验方案:
甲方案:将样品溶液与饱和澄清石灰水反应,观察现象.
乙方案:将样品溶液与BaCl2溶液反应,观察现象.
丙方案:测定pH法.
丁方案:热重分析法.
①判定甲方案不可行(填“可行”或“不可行”).
②为判定乙方案的可行性,某同学用纯净的NaHCO3配制的溶液,与BaCl2溶液等体积混合进行实验,结果如下:
NaHCO3溶液 BaCl2浓度 | 0.2mol•L-1 | 0.1mol•L-1 | 0.02mol•L-1 |
| 0.2mol•L-1 | 浑浊 | 浑浊 | 少许浑浊 |
| 0.1mol•L-1 | 浑浊 | 少许浑浊 | 无现象 |
| 0.02mol•L-1 | 少许浑浊 | 无现象 | 无现象 |
[己知:0.l mol•L-1 NaHCO3溶液电离出的c(CO32-)为0.001l mol•L-1,Ksp(BaCO3)=5.1×10-9]
答:Qc=c(Ba2+)×c(CO32-)=$\frac{0.2}{2}$×0.0011=1.1×10-4>5.1×10-9.
(ii)产生浑浊(伴有气体产生)的离子方程式Ba2++2HCO3-=BaCO3↓+CO2↑+H2O.
③用pH计测定的丙方案如下:
取m克的固体样晶溶解于水配成V mL的溶液,用pH计测pH:
还应补充的实验是:另取等质量的分析纯NaHC03溶于水中配成V mL的溶液,用pH计测pH
④进行丁方案实验,得到固体残留率随温度变化的曲线如图2所示,根据A点坐标得到的结沦是制得的固体样品是纯净的NaHCO3.
(残留率=$\frac{剩余固体的质量}{原始固体的质量}$×100%)
4.下列说法正确的是( )
| A. | 加热NH4C1晶体时,将湿润的红色石蕊试纸靠近试管口,检验NH3的生成 | |
| B. | 取少量溶液X,向其中加入适量新制氯水,再加几滴KSCN溶液,溶液变红,说明X溶液中一定含有Fe2+ | |
| C. | 除去KNO3中的少量NaCl,可将混合物制成热的饱和溶液,冷却结晶,过滤 | |
| D. | 通过灼热的镁粉除去N2中的O2 |
20.如表是元素周期表的一部分,针对表中的①⑩种元素,用 元素符号或化学式回答相关问题:
(1)在这些元素中,化学性质最不活泼的原子的原子结构示意图为 .
.
(2)这些元素中的最高价氧化物对应的水化物中,酸性最强的是HClO4,碱性最强的是KOH
(3)⑤的单质与氢氧化钠溶液反应的化学方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑.⑤的氢氧化物与氢氧化钠溶液反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O.
(4)将⑦单质通入③与⑩组成的化合物中,发生反应的离子方程为Cl2+2Br-=2Cl-+Br2.
(5)①的单质常用做工业上合成某种碱性气体,写出该碱性气体被氧气催化氧化的反应化学方程式4NH3+5O2$\frac{\underline{\;\;催化剂\;\;}}{高温高压}$4NO+6H2O.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |
 .
.(2)这些元素中的最高价氧化物对应的水化物中,酸性最强的是HClO4,碱性最强的是KOH
(3)⑤的单质与氢氧化钠溶液反应的化学方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑.⑤的氢氧化物与氢氧化钠溶液反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O.
(4)将⑦单质通入③与⑩组成的化合物中,发生反应的离子方程为Cl2+2Br-=2Cl-+Br2.
(5)①的单质常用做工业上合成某种碱性气体,写出该碱性气体被氧气催化氧化的反应化学方程式4NH3+5O2$\frac{\underline{\;\;催化剂\;\;}}{高温高压}$4NO+6H2O.
19.萜品醇可作为消毒剂、抗氧化剂和溶剂.已知α-萜品醇的结构简式如下式,则下列说法错误的是( )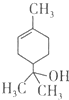

| A. | 1mol该物质最多能和lmol氢气发生加成反应 | |
| B. | 该物质属于烃 | |
| C. | 该物质能使溴水褪色 | |
| D. | 分子式为C9H16O |
18.对于放热反应2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O,下列说法正确的是( )
0 168823 168831 168837 168841 168847 168849 168853 168859 168861 168867 168873 168877 168879 168883 168889 168891 168897 168901 168903 168907 168909 168913 168915 168917 168918 168919 168921 168922 168923 168925 168927 168931 168933 168937 168939 168943 168949 168951 168957 168961 168963 168967 168973 168979 168981 168987 168991 168993 168999 169003 169009 169017 203614
| A. | 产物H20所具有的总能量高于反应物H2和O2所具有的总能量 | |
| B. | 反应物H2所具有的能量高于产物H2O所具有的总能量 | |
| C. | 反应物H2和O2所具有的总能量高于产物H2O所具有的总能量 | |
| D. | 反应物H2和02具有的能量相等 |
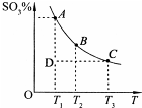 硫酸的年产量可以用来衡量一个国家的化工生产能力.工业生产硫酸的流程中存在反应:2SO2(g)+O2(g)?2SO3(g).反应体系中SO3的百分含量和温度的关系如图所示(曲线上任何一点都表示平衡状态).根据图示回答下列问题:
硫酸的年产量可以用来衡量一个国家的化工生产能力.工业生产硫酸的流程中存在反应:2SO2(g)+O2(g)?2SO3(g).反应体系中SO3的百分含量和温度的关系如图所示(曲线上任何一点都表示平衡状态).根据图示回答下列问题:
 和
和
 和
和
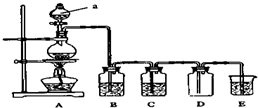 如图是实验室中制备气体或验证气体性质的装置图.
如图是实验室中制备气体或验证气体性质的装置图.