题目内容
1. 如图是实验室中制备气体或验证气体性质的装置图.
如图是实验室中制备气体或验证气体性质的装置图.(1)仪器a的名称是分液漏斗.
(2)利用上图装置制备纯净、干燥的氯气.
①圆底烧瓶内发生反应的离子方程式为MnO2+4H++2Cl-═Mn2++Cl2+2H2O;
②装置B中溶液为饱和NaCl溶液,烧杯E中溶液的作用为吸收氯气防污染.
(3)若利用图装置证明SO2具有漂白性、还原性及生成气体中含有CO2.圆底烧瓶内加入碳,a中加入浓硫酸,B、D中均为少量品红溶液,C中为足量酸性高锰酸钾溶液,E中为澄清石灰水.
①证明SO2具有漂白性的装置是B,现象是品红溶液褪色;
②证明SO2具有还原性的现象是C中KMnO4溶液褪色;
③D装置的作用是检验SO2是否除尽.
④证明生成气体中含有CO2的现象是D中品红不褪色且E中石灰水变浑浊.
分析 (1)熟悉仪器图形,说出其名称;
(2)①二氧化锰与浓盐酸在加热条件下反应生成氯化锰、水和氯气;
②浓盐酸易挥发,制取的氯气中含有氯化氢,氯化氢易溶于水氯气在水中溶解度较小,可以用饱和食盐水除去氯化氢;
氯气有毒,直接排放引起空气污染,氯气能够与氢氧化钠反应生成氯化钠、次氯酸钠和水,可用氢氧化钠溶液吸收氯气;
(3)先验证二氧化硫后验证二氧化碳,二氧化硫具有漂白性,要先在B装置中放入品红溶液验证二氧化硫;由于二氧化硫也能与石灰水反应产生沉淀会干扰二氧化碳的验证,所以在验证二氧化碳之前要保证把二氧化硫除去,这样就需要在C装置中放入酸性高锰酸钾溶液,D中装入品红溶液,检验二氧化硫是否除尽,最后用澄清石灰水检验二氧化碳的存在.
解答 解:(1)仪器a的名称是分液漏斗;
故答案为:分液漏斗;
(2)①二氧化锰与浓盐酸在加热条件下反应生成氯化锰、水和氯气,离子方程式:MnO2+4H++2Cl-═Mn2++Cl2+2H2O;
故答案为:MnO2+4H++2Cl-═Mn2++Cl2+2H2O;
②浓盐酸易挥发,制取的氯气中含有氯化氢,氯化氢易溶于水氯气在水中溶解度较小,可以用饱和食盐水除去氯化氢;氯气有毒,直接排放引起空气污染,氯气能够与氢氧化钠反应生成氯化钠、次氯酸钠和水,可用氢氧化钠溶液吸收氯气;
故答案为:饱和NaCl溶液;吸收氯气防污染;
(3)先验证二氧化硫后验证二氧化碳,二氧化硫具有漂白性,要先在B装置中放入品红溶液验证二氧化硫;由于二氧化硫也能与石灰水反应产生沉淀会干扰二氧化碳的验证,所以在验证二氧化碳之前要保证把二氧化硫除去,这样就需要在C装置中放入酸性高锰酸钾溶液,D中装入品红溶液,检验二氧化硫是否除尽,最后用澄清石灰水检验二氧化碳的存在;
①二氧化硫具有漂泊性,能够使品红溶液褪色,据此检验二氧化硫的存在;
故答案为:B;品红溶液褪色;
②证明SO2具有还原性装置为C,现象酸性高锰酸钾褪色;
故答案为:C中KMnO4溶液褪色;
③为排除二氧化硫对二氧化碳检验的干扰,应在D中加入品红溶液,检验SO2是否除尽;
故答案为:检验SO2是否除尽;
④如果D中品红不褪色,说明二氧化硫除尽,则能够使澄清石灰水变浑浊的其他
D中品红不褪色且E中石灰水变浑浊的气体为二氧化碳;
故答案为:D中品红不褪色且E中石灰水变浑浊.
点评 本题考查了氯气的制备,二氧化硫、二氧化碳的检验,熟悉装置的特点及各物质的性质是解题关键,题目难度中等.

 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案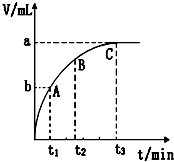 某课外兴趣小组对H2O2的分解速率做了如下实验探究.
某课外兴趣小组对H2O2的分解速率做了如下实验探究.(1)下表是该小组研究影响过氧化氢(H2O2)分解速率的因素时采集的一组数据:用10mL H2O2制取150mLO2所需的时间(秒)
| 30%H2O2 | 15%H2O2 | 10%H2O2 | 5%H2O2 | |
| 无催化剂、不加热 | 几乎不反应 | 几乎不反应 | 几乎不反应 | 几乎不反应 |
| 无催化剂、加热 | 360 | 480 | 540 | 720 |
| MnO2催化剂、加热 | 10 | 25 | 60 | 120 |
②从上述影响H2O2分解速率的因素a和b中任选一个,说明该因素对该反应速率的影响:其他条件不变,升高反应温度,H2O2分解速率加快.
(2)某同学在10mL H2O2 溶液中加入一定量的二氧化锰,放出气体的体积(标准状况)与反应时间的关系如如图所示,
①写出H2O2发生的化学反应方程式2H2O2$\frac{\underline{\;MnO_{2}\;}}{\;}$2H2O+O2↑.
②A、B、C三点所表示的即时反应速率最慢的是C.
(3)若将适量MnO2加入酸化的H2O2的溶液中,MnO2溶解产生Mn2+,另外,产物中还有O2产生,请写出该反应的离子方程式MnO2+2H++H2O2=Mn2++O2↑+2H2O.
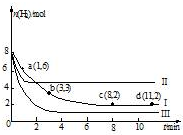 一定温度下,向容积为2L的恒容密闭容器中充入6molCO2和8molH2,发生反应:
一定温度下,向容积为2L的恒容密闭容器中充入6molCO2和8molH2,发生反应:CO2(g)+3H2?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1,测得n(H2)随时间变化如曲线I所示.下列说法正确的是( )
| A. | 该反应在0~8min内CO2的平均反应速率是0.375mol•L-1•min-1 | |
| B. | 若起始时向上述容器中充入3molCO2和4molH2,则平衡时H2的条件分数大于20% | |
| C. | 若起始是向上述容器中充入4molCO2、2molH2、2molCH3OH和1molH2O(g),则此是反应向正反应方向进行 | |
| D. | 改变条件得到曲线II、III,则曲线II、III改变的他分别是升高温度、充入氢气 |
| A. | 工业制金属钠:电解饱和食盐水 | |
| B. | 工业制溴:某些植物有富集溴的能力,从海产品中提取溴是工业上获取溴的重要途径 | |
| C. | 冶炼铝:电解Al2O3,同时加入冰晶石(Na3AlF6),目的是为了降低Al2O3熔融温度 | |
| D. | 硫酸工业:在氧气充足的情况下,从接触室进入吸收塔的气体中不可能含有SO2 |
(1)选取必要的实验装置,正确的连接顺序为CAB(填序号).
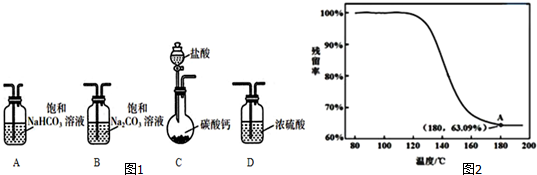
(2)为确定制得的固体样品是纯净的NaHCO3,小组同学提出下列实验方案:
甲方案:将样品溶液与饱和澄清石灰水反应,观察现象.
乙方案:将样品溶液与BaCl2溶液反应,观察现象.
丙方案:测定pH法.
丁方案:热重分析法.
①判定甲方案不可行(填“可行”或“不可行”).
②为判定乙方案的可行性,某同学用纯净的NaHCO3配制的溶液,与BaCl2溶液等体积混合进行实验,结果如下:
NaHCO3溶液 BaCl2浓度 | 0.2mol•L-1 | 0.1mol•L-1 | 0.02mol•L-1 |
| 0.2mol•L-1 | 浑浊 | 浑浊 | 少许浑浊 |
| 0.1mol•L-1 | 浑浊 | 少许浑浊 | 无现象 |
| 0.02mol•L-1 | 少许浑浊 | 无现象 | 无现象 |
[己知:0.l mol•L-1 NaHCO3溶液电离出的c(CO32-)为0.001l mol•L-1,Ksp(BaCO3)=5.1×10-9]
答:Qc=c(Ba2+)×c(CO32-)=$\frac{0.2}{2}$×0.0011=1.1×10-4>5.1×10-9.
(ii)产生浑浊(伴有气体产生)的离子方程式Ba2++2HCO3-=BaCO3↓+CO2↑+H2O.
③用pH计测定的丙方案如下:
取m克的固体样晶溶解于水配成V mL的溶液,用pH计测pH:
还应补充的实验是:另取等质量的分析纯NaHC03溶于水中配成V mL的溶液,用pH计测pH
④进行丁方案实验,得到固体残留率随温度变化的曲线如图2所示,根据A点坐标得到的结沦是制得的固体样品是纯净的NaHCO3.
(残留率=$\frac{剩余固体的质量}{原始固体的质量}$×100%)
| A. | 6.72L CO | B. | 6.6g CO2 | C. | 8 g SO2 | D. | 9.6g H2SO4 |
| A. | 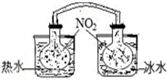 依据两容器内气体颜色变化,判断反应2NO2(g)?N2O4(g)平衡移动的方向 | |
| B. | 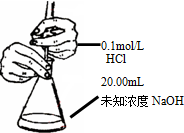 测定锥形瓶内的NaOH的浓度 | |
| C. | 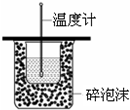 测定中和热 | |
| D. | 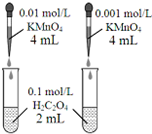 依据褪色快慢比较浓度对反应速率的影响 |
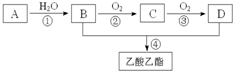 已知:A是石油裂解气的主要成份,A的产量通常用来衡量一个国 家的石油化工水平.现以A为主要原料合成乙酸乙酯,其合成路线如图所示.
已知:A是石油裂解气的主要成份,A的产量通常用来衡量一个国 家的石油化工水平.现以A为主要原料合成乙酸乙酯,其合成路线如图所示.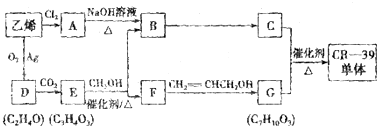
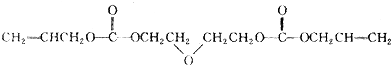
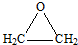 .
.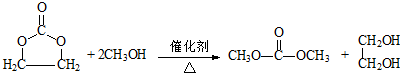 .
. .
. .
.