18.在环境检测中常用检气管法来测定空气中S02的含量,原理是S02与KIO3发生反应,用一种有机物作指示剂,其可能反应如下(未配平):①KIO3+SO2+H2O→I2+H2SO4+KHSO4 ②KIO3+SO2+H2O→KI+H2SO4,则下列说法正确的是( )
| A. | 检气管法是按照反应①原理设计的 | |
| B. | 检气管法是按照反应②原理设计的 | |
| C. | 反应①②均可以设计成检气管法,但考虑到相同量KIO3①消耗SO2少,所以检气管法是按①设计的 | |
| D. | 反应①②均可以设计成检气管法,但考虑到相同量KIO3②消耗SO2多,所以检气管法是按②设计的 |
17.下列反应的离子方程式正确的是( )
| A. | 碳酸氢镁溶液中加入过量石灰水:Mg2++2HCO3-+Ca2++2OH-═CaCO3↓+2H2O+MgCO3↓ | |
| B. | 1mo•L-1 的 NaAlO2 溶液和2.5mol•L-1 的盐酸等体积混合:2AlO2-+5 H+=Al(OH)3↓+Al3++H2 O | |
| C. | 亚硫酸氢钡溶液中加入适量双氧水:HSO3-+H2O2=SO42-+H2O+H+ | |
| D. | 硫酸亚铁溶液中加入用硫酸酸化的过氧化氢溶液:Fe2++2H++H2O2=Fe3++2H2O |
16.设NA表示阿伏加德罗常数,下列叙述中,正确的是( )
| A. | 在标准状况下,2.24 L二氧化硫与氧气混合气体中所含氧原子数为0.2 NA | |
| B. | 假设1mol氯化铁完全转化为氢氧化铁胶体,则分散系中胶体微粒数为NA | |
| C. | 60g冰醋酸中,所含阴、阳离子总数为2NA | |
| D. | 标准状况下,3.36L乙烷中含有的非极性键数为1.05NA |
14.常温下,下列叙述正确的是( )
| A. | pH=5.6的由CH3COOH与CH3COONa组成的混合溶液中:c(Na+)>c(CH3C00-) | |
| B. | 将PH=a的醋酸稀释为pH=a+1的过程中,C(OH-)不断增大 | |
| C. | 等体积pH=a的盐酸与pH=b的氨水溶液恰好中和时,a+b=14 | |
| D. | 浓度均为0.1 mol•L-1的CH3COOH溶液和氨水等体积混合后:c(CH3COO-)+c(H+)=c(NH4+)+c(OH-) |
13.在标准状况下进行甲、乙、丙三组实验.各取30mL同浓度的盐酸溶液,加入不同质量的同一种镁铝合金粉末,产生气体.有关数据记录如表:
试回答:
(1)盐酸一定过量的是(填序号)甲,盐酸一定不足量的是乙和丙;
(2)要计算合金中镁的质量分数,所提供的数据中作计算依据的是甲,镁在合金中的质量分数为53.3%;
(3)在丙组实验之后,向容器中加入1mol/L的苛性钠溶液,可恰好使铝元素全部以偏铝酸根形式存在,并使镁离子
刚好沉淀完全,则溶液中偏铝酸钠的物质的量为0.009mol,所加入的苛性钠溶液的体积为39mL.
0 168809 168817 168823 168827 168833 168835 168839 168845 168847 168853 168859 168863 168865 168869 168875 168877 168883 168887 168889 168893 168895 168899 168901 168903 168904 168905 168907 168908 168909 168911 168913 168917 168919 168923 168925 168929 168935 168937 168943 168947 168949 168953 168959 168965 168967 168973 168977 168979 168985 168989 168995 169003 203614
| 实验序号 | 甲 | 乙 | 丙 |
| 合金质量g | 0.255 | 0.385 | 0.459 |
| 生成气体体积/mL | 280 | 336 | 336 |
(1)盐酸一定过量的是(填序号)甲,盐酸一定不足量的是乙和丙;
(2)要计算合金中镁的质量分数,所提供的数据中作计算依据的是甲,镁在合金中的质量分数为53.3%;
(3)在丙组实验之后,向容器中加入1mol/L的苛性钠溶液,可恰好使铝元素全部以偏铝酸根形式存在,并使镁离子
刚好沉淀完全,则溶液中偏铝酸钠的物质的量为0.009mol,所加入的苛性钠溶液的体积为39mL.




 A~J为中学化学中常见的几种物质.它们有如图转化关系:
A~J为中学化学中常见的几种物质.它们有如图转化关系: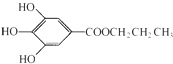 ,是白色粉末,难溶于水,微溶于棉子油等油脂,是常用的食用油抗氧化剂.
,是白色粉末,难溶于水,微溶于棉子油等油脂,是常用的食用油抗氧化剂.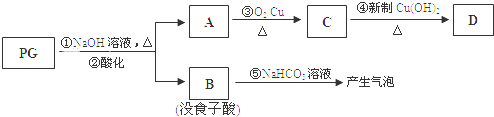
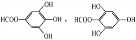
 .
.