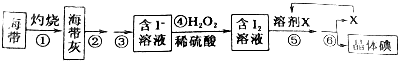
题目内容
15.没食子酸丙酯简称PG,结构简式为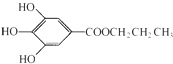 ,是白色粉末,难溶于水,微溶于棉子油等油脂,是常用的食用油抗氧化剂.
,是白色粉末,难溶于水,微溶于棉子油等油脂,是常用的食用油抗氧化剂.(1)PG的分子式为C10H12O5,请写出PG分子中所含官能团的名称酚羟基、酯基,1molPG与足量氢氧化钠溶液完全反应时,消耗的氢氧化钠的物质的量是4mol.
PG可发生如下转化:
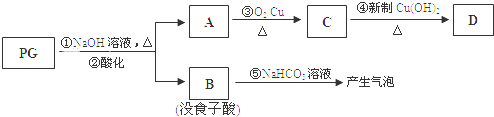
(2)③的化学反应式为2CH3CH2CH2OH+O2$→_{△}^{Cu}$2CH3CH2CHO+2H2O,1mol没食子酸最多可与3mol H2 加成.
(3)上图的有关变化中,属于氧化反应的有(填序号)③④.
(4)从分子结构或性质上看,PG具有抗氧化作用的主要原因是(填序号)cd.
A.含有苯环 B.含有羧基 C.含有酚羟基 D.微溶于食用油
(5)反应④的化学方程式为:CH3CH2CHO+2Cu(OH)2$\stackrel{△}{→}$CH3CH2COOH+Cu2O↓+2H2O
(6)B有多种同分异构体,写出其中符合下列要求的同分异构体的结构简式:
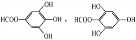
i.含有苯环,且苯环上的一溴代物只有一种;ii.既能发生银镜反应,又能发生水解反应.
分析 (1)根据PG的结构简式书写其分子式,由PG结构简式可知,PG分子中含有酯基与酚羟基,酯基(羧酸与醇形成)与酚羟基都与氢氧化钠按1:1反应,1molPG含有3mol酚羟基,1mol酯基(羧酸与醇形成),据此计算.
PG在氢氧化钠水溶液条件下发生水解反应,并酸化得到没食子酸与A,故A为:CH3CH2CH2OH,没食子酸的结构简式为: ,没食子酸含有苯环,与氢气发生加成反应;A催化氧化生成C、C与新制的氢氧化铜浊液反应生成D,则C为CH3CH2CHO、D为CH3CH2COOH;
,没食子酸含有苯环,与氢气发生加成反应;A催化氧化生成C、C与新制的氢氧化铜浊液反应生成D,则C为CH3CH2CHO、D为CH3CH2COOH;
(2)③为CH3CH2CH2OH催化氧化生成CH3CH2CHO,据此写出反应的化学方程式;
(3)属于氧化反应的为:反应③CH3CH2CH2OH氧化生成CH3CH2CHO和反应④CH3CH2CHO氧化生成CH3CH2COOH;
(4)没食子酸丙酯简微溶于油脂,含有酚羟基,易被氧化,可以防止食用油被氧化;
(5)由转换关系可知,C为CH3CH2CHO,D为CH3CH2COOH,反应④是CH3CH2CHO氧化生成CH3CH2COOH;
(6)含有苯环,且苯环上的一溴代物只有一种,说明苯环上只有1种H原子,既能发生银镜反应,又能发生水解反应,结合没食子酸的结构,说明为甲酸酚酯,据此生成符合条件的同分异构体.
解答 解:(1)根据PG的结构简式可知,其分子式为C10H12O5,由PG结构简式可知,PG分子中含有酯基与酚羟基,酯基(羧酸与醇形成)与酚羟基都与氢氧化钠按1:1反应,1molPG含有3mol酚羟基,1mol酯基(羧酸与醇形成),故1moPG与足量氢氧化钠溶液完全反应时,消耗的氢氧化钠的物质的量为4mol,
故答案为:C10H12O5;酚羟基、酯基;4mol;
PG在氢氧化钠水溶液条件下发生水解反应,并酸化得到没食子酸与A,故A为CH3CH2CH2OH,没食子酸的结构简式为 ;A催化氧化生成C、C与新制的氢氧化铜浊液反应生成D,则C为CH3CH2CHO、D为CH3CH2COOH,
;A催化氧化生成C、C与新制的氢氧化铜浊液反应生成D,则C为CH3CH2CHO、D为CH3CH2COOH,
(2)反应③为CH3CH2CH2OH催化氧化生成CH3CH2CHO,反应方程式为:CH3CH2CH2OH+O2$→_{△}^{Cu}$CH3CH2CHO+H2O;
没食子酸含有苯环,1mol没食子酸与3mol氢气发生加成反应,
故答案为:2CH3CH2CH2OH+O2$→_{△}^{Cu}$2CH3CH2CHO+2H2O;3;
(3)反应①属于水解反应,反应③是CH3CH2CH2OH氧化生成CH3CH2CHO,反应④是CH3CH2CHO氧化生成CH3CH2COOH,反应②⑤是复分解反应,所以属于氧化反应的为:③④,
故答案为:③④;
(4)没食子酸丙酯简微溶于油脂,含有酚羟基,易被氧化,可以防止食用油被氧化.
故答案为:cd;
(5)由转换关系可知,C为CH3CH2CHO,D为CH3CH2COOH,反应④是CH3CH2CHO氧化生成CH3CH2COOH,反应方程式为:CH3CH2CHO+2Cu(OH)2$\stackrel{△}{→}$CH3 CH2COOH+Cu2O↓+2H2O,
故答案为:CH3CH2CHO+2Cu(OH)2$\stackrel{△}{→}$CH3 CH2COOH+Cu2O↓+2H2O;
(6)含有苯环,且苯环上的一溴代物只有一种,说明苯环上只有1种H原子,既能发生银镜反应,又能发生水解反应,结合没食子酸的结构,说明为甲酸酚酯,符合条件的同分异构体为: ,
,
故答案为: .
.
点评 本题考查有机物的推断,题目难度较大,涉及酯、醇、醛、羧酸的性质与官能团的性质、同分异构体书写等,是对有机物知识的综合应用,理解酯类水解的原理是解题的关键,注意基础知识的积累与掌握.

 阅读快车系列答案
阅读快车系列答案| A. | 铜和稀硝酸反应 Cu+2NO3-+4H+=Cu2++2NO2↑+2H2O | |
| B. | 锌片插入硝酸银溶液中:Zn+Ag+=Zn2++Ag | |
| C. | 氯气和氢氧化钙溶液反应 Cl2+2OH-=Cl-+ClO-+H2O | |
| D. | 盐酸和氨水反应 H++OH-=H2O |
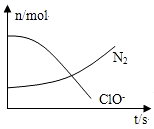
| A. | 还原剂是NH3,氧化产物是Cl- | |
| B. | 配平后氧化剂与还原剂的计量系数之比为3:2 | |
| C. | 该反应中氧化反应过程是ClO-→Cl- | |
| D. | 标准状况下,若生成2.24LN2,则转移电子为0.5 mol |
| A. | 6+m | B. | 6-m | C. | 3+m | D. | 3-m |
| A. | 化学反应中,有放热反应也有吸热反应 | |
| B. | 煤、石油、天然气是当今世界最重要的三种化石燃料 | |
| C. | Ba(OH)2•8H2O晶体与NH4Cl晶体的反应是吸热反应 | |
| D. | 化学反应中能量变化的大小与反应物的质量多少无关 |
 某课外兴趣小组对H2O2的分解速率做了如下实验探究.
某课外兴趣小组对H2O2的分解速率做了如下实验探究.(1)下表是该小组研究影响过氧化氢(H2O2)分解速率的因素时采集的一组数据:用10mL H2O2制取150mLO2所需的时间(秒)
| 30%H2O2 | 15%H2O2 | 10%H2O2 | 5%H2O2 | |
| 无催化剂、不加热 | 几乎不反应 | 几乎不反应 | 几乎不反应 | 几乎不反应 |
| 无催化剂、加热 | 360 | 480 | 540 | 720 |
| MnO2催化剂、加热 | 10 | 25 | 60 | 120 |
②从上述影响H2O2分解速率的因素a和b中任选一个,说明该因素对该反应速率的影响:其他条件不变,升高反应温度,H2O2分解速率加快.
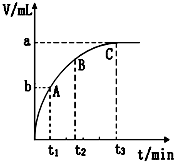
(2)某同学在10mL H2O2 溶液中加入一定量的二氧化锰,放出气体的体积(标准状况)与反应时间的关系如如图所示,
①写出H2O2发生的化学反应方程式2H2O2$\frac{\underline{\;MnO_{2}\;}}{\;}$2H2O+O2↑.
②A、B、C三点所表示的即时反应速率最慢的是C.
(3)若将适量MnO2加入酸化的H2O2的溶液中,MnO2溶解产生Mn2+,另外,产物中还有O2产生,请写出该反应的离子方程式MnO2+2H++H2O2=Mn2++O2↑+2H2O.