题目内容
20.已知Fe3+的氧化性大于Cu2+,据此性质,某工厂用FeCl3溶液腐蚀镀有铜的绝缘板生产印刷电路.用离子方程式表示其化学原理2Fe3++Cu=2Fe2++Cu2+.某实验小组的同学对该厂生产印刷电路后所得的废液进行了分析:取50.00mL废液,向其中加入0.64g金属铜,金属铜全部溶解;又取50.00mL 废液,向其中加入足量的AgNO3溶液,析出沉淀43.05g.请回答以下问题 (此题的计算结果注意有效数字,即保留两位小数):
(1)该厂生产后废液中所含金属离子有Fe3+、Fe2+、Cu2+;
(2)该厂原来使用的FeCl3溶液的物质的量浓度2mol/L(反应前后溶液的体积变化忽略不计);
(3)若向500.00mL废液中加入足量的稀硝酸,在标准状况下生成NO气体4.48L,则原废液中各金属阳离子的物质的量浓度之比为(要表示出对应的离子)c(Fe3+):c(Fe2+):c(Cu2+)=4:6:3;
(4)另取500.00mL废液,加入一定量铁屑,充分反应后有铜析出,则所得溶液中Fe2+的物质的量范围为1.2<n(Fe2+)≤1.5.
分析 铁离子具有氧化性,能和Cu发生氧化还原反应生成亚铁离子和铜离子;
(1)向溶液中加入Cu,Cu溶解说明溶液中还含有铁离子,同时溶液中还有亚铁离子和铜离子;
(2)加入硝酸银溶液得到的沉淀的AgCl,根据氯原子守恒计算原来氯化铁溶液浓度;
(3)500ml溶液加足量稀硝酸,氧化的是亚铁离子,离子方程式3Fe2++4H++NO3-=2H2O+3Fe3++NO↑,因为NO的物质的量为0.2mol所以亚铁有0.6mol.根据离子方程2Fe3++Cu=2Fe2++Cu2+可知500ml溶液中铜离子0.3mol;50ml加入足量的硝酸银溶液,析出沉淀43.05g为AgCl,物质的量为0.03mol,可知500ml溶液中含有氯离子为0.3mol,根据电荷守恒可知溶液中铁离子为0.4mol,同一溶液中,物质的量之比等于其物质的量浓度之比;
(4)向500.00mL该溶液中加入一定量铁屑,首先发生2Fe3++Fe=3Fe2+,铁离子反应完毕,再发生Cu2++Fe=Fe2++Cu,有铜开始析出时,即Fe3+恰好完全反应,溶液为氯化亚铁与氯化铜混合液,此时溶液中Fe2+最少,根据电荷守恒计算亚铁离子的物质的量.当溶液中铜离子完全析出,此时溶液中Fe2+最多,溶液为氯化亚铁溶液,根据氯离子守恒计算亚铁离子的物质的量.
解答 解:Fe3+氧化性大于Cu2+,用FeCl3溶液腐蚀镀有铜的绝缘板的离子方程式为:2Fe3++Cu=2Fe2++Cu2+,
故答案为:2Fe3++Cu=2Fe2++Cu2+;
(1)由于向废液中加入金属铜后铜全部溶解,则铁离子有剩余,废液中含生成的Fe2+、Cu2+,和剩余的Fe3+,则该厂产生的废液中所含金属离子为:Fe2+、Cu2+、Fe3+,
故答案为:Fe2+、Cu2+、Fe3+;
(2)废液加入足量的AgNO3溶液,生成沉淀43.05g为AgCl质量,其物质的量为:$\frac{43.05g}{143.5g/mol}$=0.3mol,
根据氯元素守恒,原溶液中n(FeCl3)=$\frac{1}{3}$n(AgCl)=×0.3mol=0.1mol,
故原废液中c(FeCl3)=2mol/L,
故答案为:2mol/L;
(3)500ml溶液加足量稀硝酸,氧化的是亚铁离子,离子方程式3Fe2++4H++NO3-=2H2O+3Fe3++NO↑,因为NO的物质的量为0.2mol所以亚铁有0.6mol.根据离子方程2Fe3++Cu=2Fe2++Cu2+可知500ml溶液中铜离子0.3mol;50ml加入足量的硝酸银溶液,析出沉淀43.05g为AgCl,物质的量为0.03mol,可知500ml溶液中含有氯离子为0.3mol,根据电荷守恒可知溶液中铁离子为0.4mol,同一溶液中,物质的量之比等于其物质的量浓度之比所以c(Fe3+):c(Fe2+):c(Cu2+)=n(Fe3+):n(Fe2+):n(Cu2+)=0.4mol:0.6mol:0.3mol=4:6:3,
故答案为:c(Fe3+):c(Fe2+):c(Cu2+)=4:6:3;
(4)由(3)可知500ml溶液中n(Fe3+)=0.4mol,n(Fe2+)=0.6mol,n(Cu2+)=0.3mol,n(Cl-)=3mol.
向500.00mL该溶液中加入一定量铁屑,首先发生2Fe3++Fe=3Fe2+,铁离子反应完毕,再发生Cu2++Fe=Fe2++Cu,有铜开始析出时,即Fe3+恰好完全反应,溶液为氯化亚铁与氯化铜混合液,此时溶液中Fe2+最少,根据电荷守恒可知,此时溶液中亚铁离子物质的量为n′(Fe2+)=$\frac{3mol-0.3mol×2}{2}$=1.2mol;
当溶液中铜离子完全析出,此时溶液中Fe2+最多,溶液为氯化亚铁溶液,根据氯离子守恒可知,此时亚铁离子物质的量为n″(Fe2+)=$\frac{3mol}{2}$=1.5mol,所以溶液中1.20<n(Fe2+)≤1.50,
故答案为:1.2<n(Fe2+)≤1.5.
点评 本题以铜、铁和氯化铁之间的反应为载体考查氧化还原反应的有关计算,正确判断溶液中中n(Fe3+)、n(Fe2+)、n(Cu2+)是解题的关键,注意结合原子守恒、电荷守恒进行解答,题目难度中等.

| A. | 碘和四氯化碳 | B. | AgCl和水 | ||
| C. | 一氧化碳和二氧化碳 | D. | 铁粉和铜粉 |
| A. | 食物储存在冰箱里 | |
| B. | 铁制品表面刷油漆 | |
| C. | 用5%H2SO4溶液代替25%H2SO4溶液与锌粒反应 | |
| D. | 用过氧化氢溶液制氧气时添加少量二氧化锰粉末 |
| 实验操作 | 实验目的 | |
| A | 将卤代烃加入到热NaOH溶液中一段时间后,取上层液体,加入AgNO3液产生沉淀 | 证明卤代烃中含有卤元素 |
| B | 向丙烯醛(CH2=CH-CHO)中加入足量新制银氨溶液后,滴入KMnO4(H+)溶液,观察紫色褪去 | 证明结构中存在碳碳双键 |
| C | 淀粉在硫酸催化作用下水解,将新制氢氧化铜悬浊液加入到水解后的溶液中 | 检验淀粉水解的产物葡萄糖 |
| D | 向纯碱中滴加醋酸,将产生的气体先通入饱和碳酸氢钠溶液再通入苯酚钠浓溶液 | 证明酸性:醋酸>碳酸>苯酚 |
| A. | A | B. | B | C. | C | D. | D |
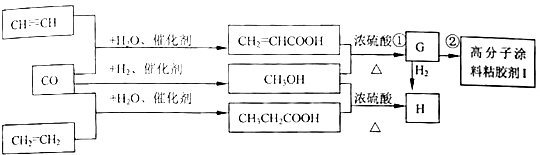
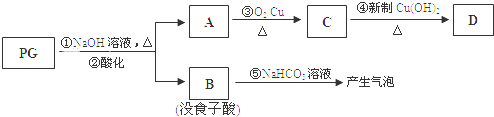
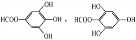
 ;
;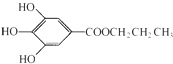 ,是白色粉末,难溶于水,微溶于棉子油等油脂,是常用的食用油抗氧化剂.
,是白色粉末,难溶于水,微溶于棉子油等油脂,是常用的食用油抗氧化剂.