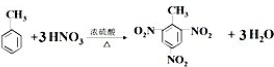
2.下列各组性质比较中,正确的是( )
①酸性:HClO4>HBrO4>HIO4
②碱性:Ca(OH)2>Mg(OH)2>Be(OH)2
③原子半径:P>S>Cl
④稳定性:HF>NH3>H2O.
①酸性:HClO4>HBrO4>HIO4
②碱性:Ca(OH)2>Mg(OH)2>Be(OH)2
③原子半径:P>S>Cl
④稳定性:HF>NH3>H2O.
| A. | ①②③ | B. | ①②③④ | C. | ①②④ | D. | ①③④ |
1.一定条件,在水溶液中物质的量均为1mol的Cl-、ClOx-(x=1,2,3,4)几种微粒的能量(kJ)相对大小与氯元素化合价的相互关系如图所示,下列说法正确的是( )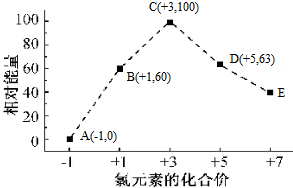

| A. | 所含氯元素的化合价越高,该物质的能量越高 | |
| B. | 所含氯元素的化合价越高,该物质越不稳定 | |
| C. | B→A+D的热化学方程式为3ClO-(aq)=2Cl-(aq)+ClO3-(aq)△H=-117kJ•mol-1 | |
| D. | ClO2-→ClO3-+ClO4-可以自发进行 |
16.以下变化过程中化学键肯定没有破坏的是( )
| A. | 水蒸气与铁粉共热 | B. | 熔融氯化镁 | ||
| C. | 乙醇溶于水 | D. | 粉碎金刚石 |
15.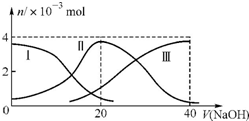 常温下,向20mL0.2mol/L H2C2O4溶液中滴加0.2mol/L NaOH溶液.有关微粒的物质的量变化曲线如图所示,[已知CaC2O4难溶于水].根据图示判断,下列说法不正确的是( )
常温下,向20mL0.2mol/L H2C2O4溶液中滴加0.2mol/L NaOH溶液.有关微粒的物质的量变化曲线如图所示,[已知CaC2O4难溶于水].根据图示判断,下列说法不正确的是( )
 常温下,向20mL0.2mol/L H2C2O4溶液中滴加0.2mol/L NaOH溶液.有关微粒的物质的量变化曲线如图所示,[已知CaC2O4难溶于水].根据图示判断,下列说法不正确的是( )
常温下,向20mL0.2mol/L H2C2O4溶液中滴加0.2mol/L NaOH溶液.有关微粒的物质的量变化曲线如图所示,[已知CaC2O4难溶于水].根据图示判断,下列说法不正确的是( )| A. | 曲线Ⅱ代表的粒子是HC2O4- | |
| B. | 当V(NaOH)=20ml时,溶液中离子浓度的大小关系为:c(Na+)>c(HC2O4-)>c(C2O42-)>c(H+)>c(OH-) | |
| C. | NaH C2O4溶液中:c(OH-)+c(C2O42-)=c(H+)+c(H2C2O4) | |
| D. | 向NaHC2O4溶液中逐渐加入CaCl2粉末并充分搅拌,溶液PH可能逐渐减小 |
14.已知NaHSO4在水中电离方程式为:NaHSO4=Na++H++SO42-.某温度下,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH为2,对于该溶液,下列叙述中不正确的是( )
0 168747 168755 168761 168765 168771 168773 168777 168783 168785 168791 168797 168801 168803 168807 168813 168815 168821 168825 168827 168831 168833 168837 168839 168841 168842 168843 168845 168846 168847 168849 168851 168855 168857 168861 168863 168867 168873 168875 168881 168885 168887 168891 168897 168903 168905 168911 168915 168917 168923 168927 168933 168941 203614
| A. | 该温度高于25℃ | |
| B. | c(H+)=c(OH-)+c(SO42-) | |
| C. | 水电离出来的c(H+)=1×10-10mol•L-1 | |
| D. | 该温度下加入等体积pH=12的NaOH溶液可使反应后的溶液恰好是中性 |
 硫酸亚铁晶体(FeSO4•7H2O)在医药上作补血剂.某课外小组的同学欲测定该补血剂中铁元素的含量.实验步骤如图:
硫酸亚铁晶体(FeSO4•7H2O)在医药上作补血剂.某课外小组的同学欲测定该补血剂中铁元素的含量.实验步骤如图: