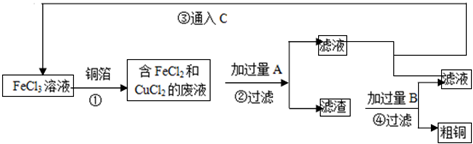
题目内容
2.下列各组性质比较中,正确的是( )①酸性:HClO4>HBrO4>HIO4
②碱性:Ca(OH)2>Mg(OH)2>Be(OH)2
③原子半径:P>S>Cl
④稳定性:HF>NH3>H2O.
| A. | ①②③ | B. | ①②③④ | C. | ①②④ | D. | ①③④ |
分析 ①元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强;
②元素的金属性越强,对应的最高价氧化物的水化物的碱性越强;
③同周期从左到右原子半径依次减小;
④元素的非金属性越强,对应阴离子的还原性越弱.
解答 解:①非金属性:Cl>Br>I,元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,则酸性:HClO4>HBrO4>HIO4,故①正确;
②金属性:Ca>Mg>Be,元素的金属性越强,对应的最高价氧化物的水化物的碱性越强,则碱性:Ca(OH)2>Mg(OH)2>Be(OH)2,故②正确;
③同周期从左到右原子半径依次减小,则原子半径:P>S>Cl,故③正确;
④非金属性F>O>N,元素的非金属性越强,对应的氢化物越稳定,则稳定性:HF>H2O>NH3,故④错误.
故选A.
点评 本题考查元素周期律知识,侧重于学生的分析能力的考查,注意把握判断的角度,注重相关基础知识的积累,难度不大.

练习册系列答案
 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案
相关题目
10.在容积固定的密闭容器中,发生反应CO2(g)+H2(g)?CO(g)+H2O(g),化学平衡常数K和温度t的关系如下表:
请回答下列问题:
(1)该反应的化学平衡常数表达式为K=$\frac{[CO]•[{H}_{2}O]}{[C{O}_{2}]•[{H}_{2}]}$;
(2)该反应为吸热反应(填“吸热”或“放热”.)
(3)能判断该反应达到化学平衡状态的是bc(填字母).
a.容器中总压强不变
b.混合气体中c(CO)不变
c.H2消耗的速率与H2O消耗的速率相等
d.c(CO2)=c(CO)
| t/℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应的化学平衡常数表达式为K=$\frac{[CO]•[{H}_{2}O]}{[C{O}_{2}]•[{H}_{2}]}$;
(2)该反应为吸热反应(填“吸热”或“放热”.)
(3)能判断该反应达到化学平衡状态的是bc(填字母).
a.容器中总压强不变
b.混合气体中c(CO)不变
c.H2消耗的速率与H2O消耗的速率相等
d.c(CO2)=c(CO)
7.高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压.高铁电池的总反应为:3Zn+2K2FeO4+8H2O $?_{充电}^{放电}$3Zn(OH)2+2Fe(OH)3+4KOH.下列叙述不正确的是( )
| A. | 放电时负极反应为:Zn-2e-+2OH-═Zn(OH)2 | |
| B. | 放电时正极反应为:FeO${\;}_{4}^{2-}$+4H2O+3e-═Fe(OH)3+5OH- | |
| C. | 放电时正极附近溶液的碱性增强 | |
| D. | 放电时每转移3mol电子,正极有1molK2FeO4被氧化 |
14.两种气态烃的混合气体共1L,在空气中燃烧生成1.5L CO2气体和2L水蒸气(气体体积均在相同状况下测定),关于该混合气体的说法不正确的是( )
| A. | 一定含有甲烷 | B. | 可能有乙烯 | ||
| C. | 一定不含有乙烷 | D. | 一定含有乙烯,不一定含有甲烷 |
11.在同温同压下,下列各组热化学方程式中,△H2>△H1的是( )
| A. | 2H2(g)+O2(g)=2H2O(g),△H1; 2H2(g)+O2(g)=2H2O(l),△H2 | |
| B. | S(g)+O2(g)=SO2(g),△H1; S(s)+O2(g)=SO2(g),△H2 | |
| C. | C(s)+$\frac{1}{2}$O2(g)=CO(g),△H1; C(s)+O2(g)=CO2(g),△H2 | |
| D. | H2(g)+Cl2(g)=2HCl(g),△H1; 2H2(g)+2Cl2(g)=4HCl(g),△H2 |
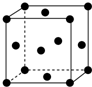 (1)写出铬原子的基态电子排布式:1s22s22p63s23p63d54s1,与铬同周期的所有元素的基态原子中最外层电子数与铬原子相同的元素有K、Cu(填元素符号),其中一种金属的晶胞结构如图所示,该晶胞中含有金属原子的数目为4.
(1)写出铬原子的基态电子排布式:1s22s22p63s23p63d54s1,与铬同周期的所有元素的基态原子中最外层电子数与铬原子相同的元素有K、Cu(填元素符号),其中一种金属的晶胞结构如图所示,该晶胞中含有金属原子的数目为4.