题目内容
17.电子工业常用质量分数为30%的氯化铁溶液腐蚀绝缘板上的铜箔,制造印刷电路板,某工程师为了从使用过的腐蚀废液中回收铜,并重新获得氯化铁溶液,他根据绿色化学理念设计了如图流程图:
(1)B的化学式为HCl,写出反应①的离子方程式:2Fe3++Cu═2Fe2++Cu2+;
(2)写出反应③的离子方程式:2Fe2++C12=2Fe3++2C1-;
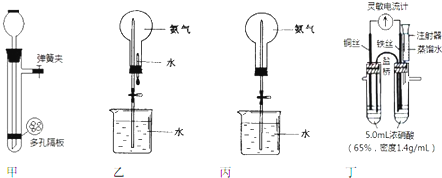
(3)能证明铁的金属活动性比铜强的离子方程式为Fe+Cu2+=Fe2++Cu.该反应的步骤②中进行;请用该反应设计一个原电池,注明电池名称、电极材料和电解质溶液;
(4)上述③步骤体现了绿色化学理念--资源循环利用.
分析 FeCl3与铜箔反应后的溶液中含有CuCl2、FeCl2,在混合液中加入过量铁粉,反应生成Fe2+、Cu,滤渣中含有Fe和Cu,除去其中的Fe选用盐酸,向氯化亚铁溶液中通入氯气生成FeCl3,可重复使用,以此解答该题.
解答 解:FeCl3与铜箔反应后的溶液中含有CuCl2、FeCl2,在混合液中加入过量铁粉,反应生成Fe2+、Cu,滤渣中含有Fe和Cu,除去其中的Fe选用盐酸,向氯化亚铁溶液中通入氯气生成FeCl3,
(1)由以上分析可知B为盐酸,氯化铁与铜反应生成氯化亚铁与氯化铁,反应方程式为:2Fe3++Cu═2Fe2++Cu2+,故答案为:HCl;2Fe3++Cu═2Fe2++Cu2+;
(2)反应③的离子方程式为2Fe2++C12=2Fe3++2C1-,故答案为:2Fe2++C12=2Fe3++2C1-;
(3)反应Fe+Cu2+=Fe2++Cu中,铁可置换出铜,可说明铁的金属活动性比铜强,在步骤②中发生该反应,用该反应设计一个原电池,可用铁为负极,碳棒为正极,硫酸铜或氯化铜溶液作电解质溶液,如图 ,
,
故答案为:Fe+Cu2+=Fe2++Cu; ;
;
(4)流程中FeCl3可循环使用,为步骤③,故答案为:③.
点评 本题考查化学工艺流程、根据方程的计算、元素化合物性质等,掌握元素化合物的性质、混合物的分离、提纯方法是解决本题的关键,题目难度中等.

练习册系列答案
相关题目
7.下列关于化学用语的表示正确的是( )
| A. | 过氧化钠的电子式: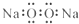 | |
| B. | 硫离子的结构示意图: | |
| C. | NH4Cl的电子式: | |
| D. | 质子数为35、中子数为45的溴原子:${\;}_{35}^{80}$Br |
8. 节能减排与我们的生活息息相关,参与节能减排是每一位公民应尽的义务.下列举措不符合这一要求的是( )
节能减排与我们的生活息息相关,参与节能减排是每一位公民应尽的义务.下列举措不符合这一要求的是( )
 节能减排与我们的生活息息相关,参与节能减排是每一位公民应尽的义务.下列举措不符合这一要求的是( )
节能减排与我们的生活息息相关,参与节能减排是每一位公民应尽的义务.下列举措不符合这一要求的是( )| A. | 倡导开私家车的人乘公交车上下班 | |
| B. | 用节能灯代替白炽灯 | |
| C. | 政府鼓励科研和生产部门开发、利用太阳能 | |
| D. | 加快开发石油以缓解能源紧张问题 |
12.可能存在的第119号元素,有人称“类钫”,据周期表结构及元素性质变化趋势,有关“类钫”的预测正确的是( )
| A. | “类钫”属过渡元素,具有放射性 | B. | “类钫”可与水剧烈反应 | ||
| C. | “类钫”单质的密度小于1g/cm3 | D. | “类钫”单质有较高熔点 |
2.下列各组性质比较中,正确的是( )
①酸性:HClO4>HBrO4>HIO4
②碱性:Ca(OH)2>Mg(OH)2>Be(OH)2
③原子半径:P>S>Cl
④稳定性:HF>NH3>H2O.
①酸性:HClO4>HBrO4>HIO4
②碱性:Ca(OH)2>Mg(OH)2>Be(OH)2
③原子半径:P>S>Cl
④稳定性:HF>NH3>H2O.
| A. | ①②③ | B. | ①②③④ | C. | ①②④ | D. | ①③④ |
9.在共价化合物中,成键原子通过共用电子对形成共价键共用电子对由双方共同提供并且共同分享,那么,在共价化合物中元素化合价有正负之分的主要原因是( )
| A. | 电子有得失 | B. | 共用电子对有偏移 | ||
| C. | 电子既有得失又有偏移 | D. | 金属元素的存在 |
6.二氧化锰与浓盐酸作用制氯气的反应中,作为还原剂的HCl和参加反应的HCl物质的量之比是( )
| A. | 1:1 | B. | 2:1 | C. | 1:2 | D. | 任意比 |