6. 硫酸钡为强酸强碱的难溶性盐,俗名叫重晶石.
硫酸钡为强酸强碱的难溶性盐,俗名叫重晶石.
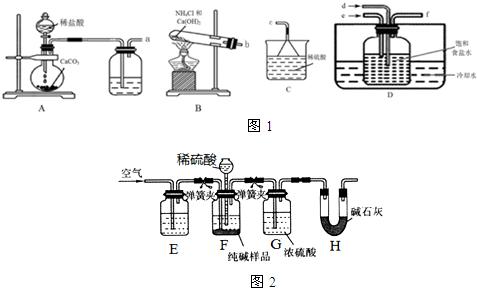
(1)以浓硫酸为电解质,按如图装置实验,小灯泡昏暗.请写出浓硫酸的电离方程式H2SO4?H++HSO4-或2H2SO4?H3SO4++HSO4-;向硫酸中撒入硫酸钡细粉,灯泡会渐渐明亮起来.用化学方程式表示增亮的原因BaSO4+H2SO4=Ba2++2HSO4-.
(2)重晶石直接开发利率很难,目前主要是通过两种途径进行开发:
一是把重晶石碾碎撒入饱和碳酸钠溶液中,不停搅拌,尔后过滤,将滤渣投入相应的酸中溶解,转化为相应的水溶性钡盐.用离子方程式表示碳酸钠溶液溶蚀硫酸钡的原理CO32-+BaSO4?BaCO3+SO42-;
其二是高温热还原:BaSO4+4C═BaS+4CO …①
BaSO4+4H2═BaS+4H2O …②.试比较①②两种还原开发的优劣①原料易得,成本低,不足之处是原料原料率不高,污染严重;
②原料利用率高,不足之处是成本高,有副反应发生,产品纯度低;.CO能不能还原硫酸钡?若认为不能,请说明理由,若能,你认为应该如何促使反应顺利进行,写出反应方程式.BaS热水中易水解,生成的H2S受热分解,BaSO4+4CO=BaS+4CO2
②中氢可利用炼油中的重油CxHy催化氧化还原获得.其反应思路式为:2CxHy+4xH2O?2xCO2+y+4xH2,配平该反应方程式;指出氧化剂水、CxHy;还原剂CxHy.
(3)已知:
①正向反应的反应热△H>0(“>”“<”“=”);
②较理想的反应温度应该控制在500℃.
(4)请运用你所学知识,设计一个新的开发重晶石方案BaSO4+4H2=BaS+4H2O[利用生物催化剂,利用厌氧硫化菌].
(5)从理论上讲CxHy+H2O→CO2+H2的反应是一个焓增、熵增反应(从反应原理角度回答);该反应的逆向反应:CO2+H2→CxHy+H2O开发意义重大,你认为最需要解决的两大问题分别是①利用绿色能源、②寻找理想催化剂(生物催化剂).
 硫酸钡为强酸强碱的难溶性盐,俗名叫重晶石.
硫酸钡为强酸强碱的难溶性盐,俗名叫重晶石.(1)以浓硫酸为电解质,按如图装置实验,小灯泡昏暗.请写出浓硫酸的电离方程式H2SO4?H++HSO4-或2H2SO4?H3SO4++HSO4-;向硫酸中撒入硫酸钡细粉,灯泡会渐渐明亮起来.用化学方程式表示增亮的原因BaSO4+H2SO4=Ba2++2HSO4-.
(2)重晶石直接开发利率很难,目前主要是通过两种途径进行开发:
一是把重晶石碾碎撒入饱和碳酸钠溶液中,不停搅拌,尔后过滤,将滤渣投入相应的酸中溶解,转化为相应的水溶性钡盐.用离子方程式表示碳酸钠溶液溶蚀硫酸钡的原理CO32-+BaSO4?BaCO3+SO42-;
其二是高温热还原:BaSO4+4C═BaS+4CO …①
BaSO4+4H2═BaS+4H2O …②.试比较①②两种还原开发的优劣①原料易得,成本低,不足之处是原料原料率不高,污染严重;
②原料利用率高,不足之处是成本高,有副反应发生,产品纯度低;.CO能不能还原硫酸钡?若认为不能,请说明理由,若能,你认为应该如何促使反应顺利进行,写出反应方程式.BaS热水中易水解,生成的H2S受热分解,BaSO4+4CO=BaS+4CO2
②中氢可利用炼油中的重油CxHy催化氧化还原获得.其反应思路式为:2CxHy+4xH2O?2xCO2+y+4xH2,配平该反应方程式;指出氧化剂水、CxHy;还原剂CxHy.
(3)已知:
| 反应温度 | 300℃ | 400℃ | 500℃ | 600℃ | 700℃ |
| 平衡常数 | 3.8 | 5.7 | 8.5 | 9.2 | 9.8 |
②较理想的反应温度应该控制在500℃.
(4)请运用你所学知识,设计一个新的开发重晶石方案BaSO4+4H2=BaS+4H2O[利用生物催化剂,利用厌氧硫化菌].
(5)从理论上讲CxHy+H2O→CO2+H2的反应是一个焓增、熵增反应(从反应原理角度回答);该反应的逆向反应:CO2+H2→CxHy+H2O开发意义重大,你认为最需要解决的两大问题分别是①利用绿色能源、②寻找理想催化剂(生物催化剂).
5.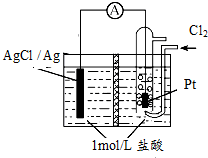 某原电池装置如图所示,中间是某种离子交换膜,电池总反应为2Ag+Cl2═2AgCl.下列说法正确的是( )
某原电池装置如图所示,中间是某种离子交换膜,电池总反应为2Ag+Cl2═2AgCl.下列说法正确的是( )
 某原电池装置如图所示,中间是某种离子交换膜,电池总反应为2Ag+Cl2═2AgCl.下列说法正确的是( )
某原电池装置如图所示,中间是某种离子交换膜,电池总反应为2Ag+Cl2═2AgCl.下列说法正确的是( )| A. | 电池放电时的负极反应为Ag-e-=Ag+ | |
| B. | 若使用阳离子交换膜,当电路中转移0.01 mol e-时,交换膜左侧溶液质量减少36.5g | |
| C. | 以Pt作电极,除了导电之外,还有催化剂的作用 | |
| D. | 用该电池给铅蓄电池充电,若有11.2L的Cl2参加电池反应,则理论上铅蓄电池的负极质量增加48g |
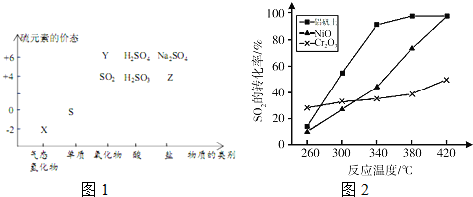
4.如图是部分短周期元素原子(用字母表示)最外层电子数与原子序数的关系图.下列说法正确的是( )
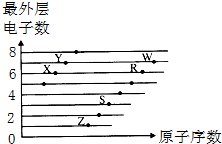

| A. | X的某种单质是一种新型自来水消毒剂 | |
| B. | 简单离子半径:W->R2->X2->S3+ | |
| C. | R、Z不可能形成离子化合物 | |
| D. | 字母所代表的元素中最高价氧化物的水化物酸性最强的是Y |
3.下列说法正确的是( )
| A. | pH计(也叫酸度计)不可能用于酸碱中和滴定终点的判断 | |
| B. | 利用二氧化碳等原料合成的聚碳酸酯类可降解塑料替代聚乙烯塑料,可减少“白色污染”,聚碳酸酯是一种新型无机非金属材料 | |
| C. | 麦芽糖是高分子化合物,可以发生银镜反应,但是其水解产物不能发生银镜反应 | |
| D. | 石油在催化剂和加热条件下的结构重整是制取苯、甲苯等芳香烃的一种重要方法 |
2.把a mol C2H4跟b mol H2混合在密闭容器中,在适当条件下,反应达到平衡时生成p molC2H6,若将所得平衡混和气体完全燃烧生成二氧化碳和水,需要氧气的量是( )
| A. | (3a+b)mol | B. | (3a+$\frac{b}{2}$)mol | C. | (3a+3p+$\frac{b}{2}$)mol | D. | (3a+$\frac{b}{2}$-3p)mol |
20.能正确表示下列反应的离子方程式是( )
| A. | 氢氧化钡溶液与过量稀硫酸反应:OH-+Ba2++SO42-+H+=BaSO4↓+H2O | |
| B. | 碳酸氢钙与过量的NaOH 溶液反应:Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+CO32- | |
| C. | 氯化铝溶液与过量的氨水反应:Al3++4OH-=AlO2-+2H2O | |
| D. | 稀硝酸与过量的铁屑反应:3Fe+8H++2NO3-=3Fe3++2NO↑+4H2O |
19.下列实验操作正确的是( )
| 编号 | 实验 | 操作 |
| A | 钠与水反应 | 用镊子从煤油中去除金属钠,切下绿豆大小的钠,小心放入装满水的烧杯中 |
| B | 配制一定浓度的碳酸钠溶液1000mL | 准确称取碳酸的固体,放入到1000mL的容量瓶中,加水溶解,振荡摇匀、定容 |
| C | 排除碱式滴定管尖嘴部分的气泡 | 将胶管弯曲使玻璃尖嘴斜向上,用两指捏住胶管,轻轻挤压玻璃珠,使溶液从尖嘴流出 |
| D | 去除分液漏斗中所需的上层液体 | 下层液体从分液漏斗下端管口放出至截面上,关闭活塞,换一个接收容器,上层液体继续从分液漏斗下端放出 |
| A. | A | B. | B | C. | C | D. | D |
18.短周期元素X、Y、Z的原子序数依次递增,其原子的最外层电子数之和为14.X 与Y、Z位于相邻周期,X原子内层电子数与Y原子最外层电子数相等,Z原子最外层电子数比X的最外层电子数多2.下列说法正确的是( )
0 168714 168722 168728 168732 168738 168740 168744 168750 168752 168758 168764 168768 168770 168774 168780 168782 168788 168792 168794 168798 168800 168804 168806 168808 168809 168810 168812 168813 168814 168816 168818 168822 168824 168828 168830 168834 168840 168842 168848 168852 168854 168858 168864 168870 168872 168878 168882 168884 168890 168894 168900 168908 203614
| A. | Y的氧化物是离子化合物 | |
| B. | X的氢化物溶于水显酸性 | |
| C. | 常温时Z单质的氧化性比X单质的氧化性弱 | |
| D. | X和 Z的最高价氧化物对应的水化物都是弱酸 |