2.下列装置或操作能达到实验目的是( )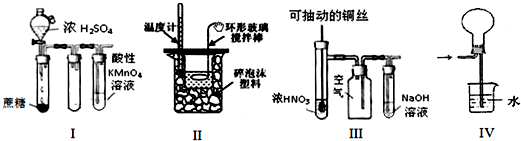

| A. | 实验Ⅰ:酸性KMnO4溶液中出现气泡,且颜色逐渐褪去 | |
| B. | 实验Ⅱ:中和热测定 | |
| C. | 实验Ⅲ:可用来制取并收集NO2 | |
| D. | 实验Ⅳ:可用于HCl气体的吸收 |
1.下列说法正确的是( )
| A. | 按系统命名法,化合物 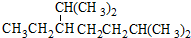 的名称为2,6-二甲基-5-乙基庚烷 的名称为2,6-二甲基-5-乙基庚烷 | |
| B. | 符合分子式为C3H4Cl2的所有同分异构体数目为7种 | |
| C. | 丁烷、正戊烷、新戊烷、已烷的沸点依次升高 | |
| D. |  、 、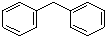 分别叫做联苯和二苯甲烷,互为同系物,两种分子的所有原子都有可能共平面 分别叫做联苯和二苯甲烷,互为同系物,两种分子的所有原子都有可能共平面 |
18.在人类文明的历程中,改变世界的事物很多,其中铁、硝酸钾、青霉素、氨、乙醇、二氧化碳、聚乙烯、二氧化硅等多种“分子”改变过人类的世界.
(1)铁原子在基态时,价电子(外围电子)排布式为3d64s2.
(2)硝酸钾中NO3-空间构型为平面三角形,写出与NO3-为等电子体的一种非极性分子化学式BF3[SO3(g)、BBr3等].
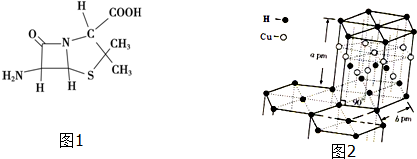
(3)6-氨基青霉烷酸的结构如图1所示,其中采用sp3杂化的原子有C、N、O、S.
(4)下列说法正确的有a(填字母序号).
a.乙醇分子间可形成氢键,导致其沸点比氯乙烷高
b.钨的配合物离子[W(CO)5OH]-能催化固定CO2,该配离子中钨显-1价
c.聚乙烯分子中有5n个σ键
d.由下表中数据可确定在反应Si(s)+O2(g)═SiO2(s)中,每生成60g SiO2放出的能量为(2c-a-b)kJ
(5)OF2与H2O分子结构十分相似,但H2O分子的极性很强,而OF2分子的极性却很小.试从原子的电负性和中心原子上的孤电子对角度解释原因:从电负性上看,氧与氢的电负性大于氧与氟的电负性差值;②OF2中氧原子上有两对孤电子对,抵消了F-O键中共用电子对偏向F而产生的极性
(6)铜元素与氢元素形成的一种红色离子化合物,其晶体结构如图2所示.则该晶体的化学式为CuH,密度为$\frac{6×65}{\frac{3\sqrt{3}}{2}a{b}^{2}×1{0}^{-30}{N}_{A}}$g.cm-3(列式即可,阿佛加特罗定律常数的值用NA表示)
(1)铁原子在基态时,价电子(外围电子)排布式为3d64s2.
(2)硝酸钾中NO3-空间构型为平面三角形,写出与NO3-为等电子体的一种非极性分子化学式BF3[SO3(g)、BBr3等].
(3)6-氨基青霉烷酸的结构如图1所示,其中采用sp3杂化的原子有C、N、O、S.

(4)下列说法正确的有a(填字母序号).
a.乙醇分子间可形成氢键,导致其沸点比氯乙烷高
b.钨的配合物离子[W(CO)5OH]-能催化固定CO2,该配离子中钨显-1价
c.聚乙烯分子中有5n个σ键
d.由下表中数据可确定在反应Si(s)+O2(g)═SiO2(s)中,每生成60g SiO2放出的能量为(2c-a-b)kJ
| 化学键 | Si-Si | O═O | Si-O | |
| 键能(kJ•mol-1) | a | b | c | |
(6)铜元素与氢元素形成的一种红色离子化合物,其晶体结构如图2所示.则该晶体的化学式为CuH,密度为$\frac{6×65}{\frac{3\sqrt{3}}{2}a{b}^{2}×1{0}^{-30}{N}_{A}}$g.cm-3(列式即可,阿佛加特罗定律常数的值用NA表示)
14.短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T是地壳含量最多的金属元素,W所处的周期序数是其原子最外层电子数的一半.
(1)R的原子结构示意图是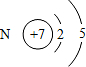 ,用化学方程式表示工业上常用于冶炼T单质的原理是2Al2O3$\frac{\underline{\;通电\;}}{\;}$4Al+3O2↑.
,用化学方程式表示工业上常用于冶炼T单质的原理是2Al2O3$\frac{\underline{\;通电\;}}{\;}$4Al+3O2↑.
(2)元素的非金属性:Q弱于W(填“强于”或“弱于”),简述其原因是最高价氧化物对应水化物碳酸是弱酸而硫酸是强酸.
(3)元素X与T同周期,且在该周期中原子半径最大,请写出X的最高价氧化物的水化物与T的最高价氧化物的水化物反应的离子方程式OH-+Al(OH)3=AlO2-+2H2O.
0 168701 168709 168715 168719 168725 168727 168731 168737 168739 168745 168751 168755 168757 168761 168767 168769 168775 168779 168781 168785 168787 168791 168793 168795 168796 168797 168799 168800 168801 168803 168805 168809 168811 168815 168817 168821 168827 168829 168835 168839 168841 168845 168851 168857 168859 168865 168869 168871 168877 168881 168887 168895 203614
| Q | R | ||
| T | W |
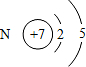 ,用化学方程式表示工业上常用于冶炼T单质的原理是2Al2O3$\frac{\underline{\;通电\;}}{\;}$4Al+3O2↑.
,用化学方程式表示工业上常用于冶炼T单质的原理是2Al2O3$\frac{\underline{\;通电\;}}{\;}$4Al+3O2↑.(2)元素的非金属性:Q弱于W(填“强于”或“弱于”),简述其原因是最高价氧化物对应水化物碳酸是弱酸而硫酸是强酸.
(3)元素X与T同周期,且在该周期中原子半径最大,请写出X的最高价氧化物的水化物与T的最高价氧化物的水化物反应的离子方程式OH-+Al(OH)3=AlO2-+2H2O.
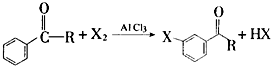

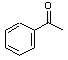 +Br2$\stackrel{AlCl_{3}}{→}$
+Br2$\stackrel{AlCl_{3}}{→}$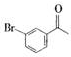 +HBr
+HBr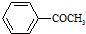 的符合以下条件的同分异构体还有4种(不包括原料本身),条件:结构中必须含有苯环和
的符合以下条件的同分异构体还有4种(不包括原料本身),条件:结构中必须含有苯环和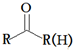 ,其中核磁共振氢谱图中共有5个吸收峰的分子的结构简式为
,其中核磁共振氢谱图中共有5个吸收峰的分子的结构简式为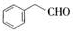
 )和乙醇为原料合成苯乙酸乙酯,如图
)和乙醇为原料合成苯乙酸乙酯,如图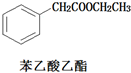 :
: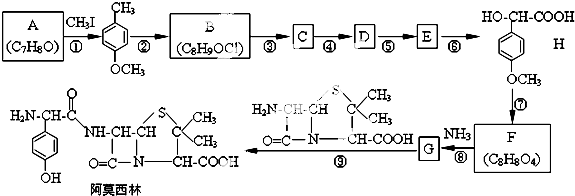
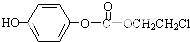 ,该物质在NaOH水溶液中加热反应时的化学方程式为
,该物质在NaOH水溶液中加热反应时的化学方程式为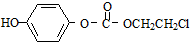 +5NaOH$→_{△}^{H_{2}O}$
+5NaOH$→_{△}^{H_{2}O}$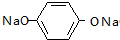 +HOCH2CH2OH+Na2CO3+NaCl+2H2O.
+HOCH2CH2OH+Na2CO3+NaCl+2H2O.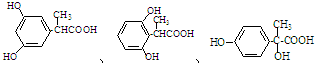 .
.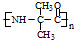 的合成路线流程图(无机试剂任用).
的合成路线流程图(无机试剂任用).
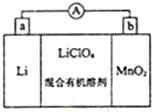 锂锰电池的体积小,性能优良,是常用的一次电池.该电池反应原理如图所示,其中电解质LiClO4溶于混合有机溶剂中,Li+ 通过电解质可以自由迁移,正极反应式为:MnO2+Li++e-=LiMnO2.回答下列问题:
锂锰电池的体积小,性能优良,是常用的一次电池.该电池反应原理如图所示,其中电解质LiClO4溶于混合有机溶剂中,Li+ 通过电解质可以自由迁移,正极反应式为:MnO2+Li++e-=LiMnO2.回答下列问题: ,丙烯发生加聚反应得到的产物不能(填:“能”“不能”)使酸性KMnO4溶液褪色,丙烯分子中能够共平面的原子最多为7 个.
,丙烯发生加聚反应得到的产物不能(填:“能”“不能”)使酸性KMnO4溶液褪色,丙烯分子中能够共平面的原子最多为7 个.