题目内容
1.下列说法正确的是( )| A. | 按系统命名法,化合物 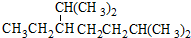 的名称为2,6-二甲基-5-乙基庚烷 的名称为2,6-二甲基-5-乙基庚烷 | |
| B. | 符合分子式为C3H4Cl2的所有同分异构体数目为7种 | |
| C. | 丁烷、正戊烷、新戊烷、已烷的沸点依次升高 | |
| D. |  、 、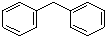 分别叫做联苯和二苯甲烷,互为同系物,两种分子的所有原子都有可能共平面 分别叫做联苯和二苯甲烷,互为同系物,两种分子的所有原子都有可能共平面 |
分析 A、烷烃命名中,选取距离支链最近的一端命名为1号碳;
B、C3H4Cl2的不饱和度为1,可以形成1个双键或1个环,据此解答即可;
C、常温下,同分异构体中含有支链越多其烷烃熔沸点越低;
D、二苯甲烷中出现亚甲基,亚甲基为四面体结构,据此解答即可.
解答 解:A、依据系统命名方法,名称中起点选错,物质的名称为:名称为2,6-二甲基-3-乙基庚烷,故A错误;
B、C3H4Cl2的不饱和度为1,可以形成1,1-二氯-1-丙烯、1,2-二氯-1-丙烯、1,3-二氯-1-丙烯、2,3-二氯-1-丙烯、3,3-二氯-1-丙烯、1,1-二氯环丙烷、1,2-二氯环丙烷,故总共7种,故B正确;
C、常温下,同分异构体中含有支链越多其烷烃熔沸点越低,所以正戊烷、新戊烷的沸点依次减小,故C错误;
D、 中间为亚甲基,亚甲基为四面体结构,故所有原子不可能共平面,故D错误,故选B.
中间为亚甲基,亚甲基为四面体结构,故所有原子不可能共平面,故D错误,故选B.
点评 本题考查了烷烃命名方法,同分异构体数目判断、烷烃熔沸点规律、有机物的结构等,题目难度中等.

练习册系列答案
 轻松暑假总复习系列答案
轻松暑假总复习系列答案
相关题目
12.原子序数依次增大的四种短周期元素X、Y、Z、W,其中Y、Z、W同周期,X和W同主族,简单离子半径的大小为X->Y+,其中Z为地壳中含量最高的金属元素,则下列说法正确的是( )
| A. | X的非金属性强于W,所以X的氢化物沸点高于W的氢化物沸点 | |
| B. | Y、Z均为金属元素,故X、Y、Z三种元素不能形成化合物 | |
| C. | 工业上常利用电解ZW3溶液冶炼金属Z | |
| D. | Y、W的最高价氧化物水化物均能溶解Z单质 |
9.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 1molNa2O和Na2O2混合物中含有的阴、阳离子总数是3NA | |
| B. | 1molCl2与足量Fe反应转移电子数一定为3NA | |
| C. | 1mol氨基(-NH2)中含电子数为10nA | |
| D. | 标况下,11.2LSO3所含的分子数目为0.5NA |
6.向溶液中分别通入足量的相应气体后,下列各组离子还能大量存在的是( )
| A. | 氯气:K+、Na+、SiO32-、NO3- | B. | 二氧化硫:Na+、NH4+、SO32-、C1- | ||
| C. | 氨气:K+、Na+、AlO2-、CO32- | D. | 乙烯:H+、K+、MnO4-、SO42- |
13.A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,其中元素A、E的单质在常温下呈气态,元素B的原子最外层电子数是其电子层数的2倍,元素C在同周期的主族元素中原子半径最大,元素D的合金是日常生活中常用的金属材料.下列说法正确的是( )
| A. | 元素A、B组成的化合物常温下一定呈气态 | |
| B. | 工业上常用电解法制备元素C、D、E的单质 | |
| C. | 化合物AE、CE都是电解质,融化状态下能被电解 | |
| D. | 一定条件下,元素D、E的最高价氧化物对应的水化物之间不能发生反应 |
5.25℃时,0.1mol/L的盐酸中,由水电离产生的c(H+)为( )
| A. | 1×10-1mol/L | B. | 1×10-7mol/L | C. | 1×10-11mol/L | D. | 1×10-13 mol/L |
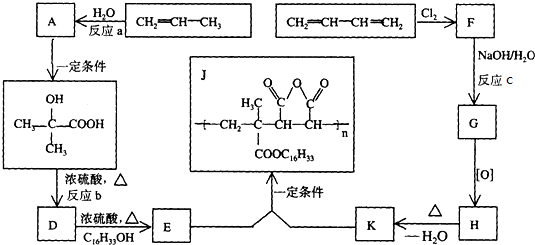
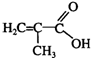 +C16H33OH$→_{△}^{浓硫酸}$
+C16H33OH$→_{△}^{浓硫酸}$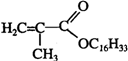 +H2OE+K→J
+H2OE+K→J
 ,丙烯发生加聚反应得到的产物不能(填:“能”“不能”)使酸性KMnO4溶液褪色,丙烯分子中能够共平面的原子最多为7 个.
,丙烯发生加聚反应得到的产物不能(填:“能”“不能”)使酸性KMnO4溶液褪色,丙烯分子中能够共平面的原子最多为7 个.