题目内容
3.苯氧布洛芬钙是评价较好的解热、镇痛、消炎药,其消炎作用比阿司匹林强50倍,欧美国家将它作为治疗慢性关节炎的首选药.最近我省某企业根据本厂实际情况以苯乙酮为原料研制了新的合成路线,其反应如下:信息一:已知:盐酸、三氯化磷、氯化亚砜(SOCl2)均可与醇发生反应,醇的羟基被氯原子取代而生成氯代烃.
信息二:已知:
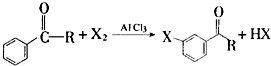
信息三:R-X+NaCN→R-CN+NaX
某企业根据本厂实际情况以苯乙酮为原料研制了新的合成路线,其反应如下:

(1)写出下列物质的结构简式:B

(2)B→C的反应类型是还原(或加成)反应;F中所含的官能团名称是羧基、醚键
(3)写出苯乙酮生成A的化学方程式
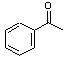 +Br2$\stackrel{AlCl_{3}}{→}$
+Br2$\stackrel{AlCl_{3}}{→}$ +HBr
+HBr(4)判断原料
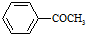 的符合以下条件的同分异构体还有4种(不包括原料本身),条件:结构中必须含有苯环和
的符合以下条件的同分异构体还有4种(不包括原料本身),条件:结构中必须含有苯环和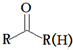 ,其中核磁共振氢谱图中共有5个吸收峰的分子的结构简式为
,其中核磁共振氢谱图中共有5个吸收峰的分子的结构简式为
(5)结合上述推断及所学知识,请设计合理的方案:
以苯甲醛(
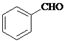 )和乙醇为原料合成苯乙酸乙酯,如图
)和乙醇为原料合成苯乙酸乙酯,如图 :
:①合成过程中无机试剂任选;
②用合成路线流程图表示,并注明反应条件.合成路线流程图示例如下:
CH3CH2OH$→_{170℃}^{浓硫酸}$H2C=CH2$\stackrel{Br_{2}}{→}$ BrH2C-CH2Br.
分析  与溴单质发生信息反应二生成A,则A为
与溴单质发生信息反应二生成A,则A为 ;A与苯酚钾反应生成B,结合最终产物可知该反应为取代反应,反应生成的
;A与苯酚钾反应生成B,结合最终产物可知该反应为取代反应,反应生成的
B为 ;B与氢气发生加成反应生成C,则C为
;B与氢气发生加成反应生成C,则C为 ;C与氯化亚砜(SOCl2)发生信息反应一生成D,则D的结构简式为:
;C与氯化亚砜(SOCl2)发生信息反应一生成D,则D的结构简式为: ;D与NaCN发生现象反应三生成E,则E为
;D与NaCN发生现象反应三生成E,则E为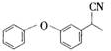 ;E先与氢氧化钠反应,然后酸化得到F,结合最终产物可知F为
;E先与氢氧化钠反应,然后酸化得到F,结合最终产物可知F为 ,F与氯化钙反应得到苯氧布洛芬钙,据此进行解答(1)~(4);
,F与氯化钙反应得到苯氧布洛芬钙,据此进行解答(1)~(4);
(5)以苯甲醛( )和乙醇为原料合成苯乙酸乙酯,还缺少苯乙酸,苯甲醛比苯乙酸少1个C,需要利用题干合成流程中的信息反应,先用苯甲醛与氢气发生加成反应得到苯甲醇,苯甲醇与溴化氢发生取代反应生成
)和乙醇为原料合成苯乙酸乙酯,还缺少苯乙酸,苯甲醛比苯乙酸少1个C,需要利用题干合成流程中的信息反应,先用苯甲醛与氢气发生加成反应得到苯甲醇,苯甲醇与溴化氢发生取代反应生成 ,
, 与NaCN发生反应生成
与NaCN发生反应生成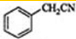 ,
, 先与氢氧化钠发生反应①,然后酸化得到苯乙酸,最后苯乙酸与乙醇在浓硫酸、加热作用下得到苯乙酸乙酯,据此写出该合成流程.
先与氢氧化钠发生反应①,然后酸化得到苯乙酸,最后苯乙酸与乙醇在浓硫酸、加热作用下得到苯乙酸乙酯,据此写出该合成流程.
解答 解: 与溴单质发生信息反应二生成A,则A为
与溴单质发生信息反应二生成A,则A为 ;A与苯酚钾反应生成B,结合最终产物可知该反应为取代反应,反应生成的B为
;A与苯酚钾反应生成B,结合最终产物可知该反应为取代反应,反应生成的B为 ;B与氢气发生加成反应生成C,则C为
;B与氢气发生加成反应生成C,则C为 ;C与氯化亚砜(SOCl2)发生信息反应一生成D,则D的结构简式为:
;C与氯化亚砜(SOCl2)发生信息反应一生成D,则D的结构简式为: ;D与NaCN发生现象反应三生成E,则E为
;D与NaCN发生现象反应三生成E,则E为 ;E先与氢氧化钠反应,然后酸化得到F,结合最终产物可知F为
;E先与氢氧化钠反应,然后酸化得到F,结合最终产物可知F为 ,F与氯化钙反应得到苯氧布洛芬钙,
,F与氯化钙反应得到苯氧布洛芬钙,
(1)根据分析可知,B的结构简式为: ,
,
故答案为: ;
;
(2)B 与氢气发生加成反应生成C:
与氢气发生加成反应生成C: ;F为
;F为 ,其含有的官能团为醚键和羧基,
,其含有的官能团为醚键和羧基,
故答案为:还原(或加成)反应; 羧基、醚键;
(3)A为 ,苯乙酮与溴单质发生信息反应而生成A,该反应的化学方程式为:
,苯乙酮与溴单质发生信息反应而生成A,该反应的化学方程式为: +Br2$\stackrel{AlCl_{3}}{→}$
+Br2$\stackrel{AlCl_{3}}{→}$ +HBr,
+HBr,
故答案为: +Br2$\stackrel{AlCl_{3}}{→}$
+Br2$\stackrel{AlCl_{3}}{→}$ +HBr;
+HBr;
(4)原料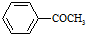 的同分异构体中,含有苯环和
的同分异构体中,含有苯环和 的有机物有:
的有机物有: 、
、 、
、 、
、 ,总共含有4种;其中核磁共振氢谱图中共有5个吸收峰,说明其分子中含有5种等效H,满足该条件的分子的结构简式为:
,总共含有4种;其中核磁共振氢谱图中共有5个吸收峰,说明其分子中含有5种等效H,满足该条件的分子的结构简式为: ,
,
故答案为:4; ;
;
(5)以苯甲醛( )和乙醇为原料合成苯乙酸乙酯:
)和乙醇为原料合成苯乙酸乙酯: ,还缺少苯乙酸,苯甲醛比苯乙酸少1个C,需要利用题干合成流程中的信息反应,先用苯甲醛与氢气发生加成反应得到苯甲醇,苯甲醇与溴化氢发生取代反应生成
,还缺少苯乙酸,苯甲醛比苯乙酸少1个C,需要利用题干合成流程中的信息反应,先用苯甲醛与氢气发生加成反应得到苯甲醇,苯甲醇与溴化氢发生取代反应生成 ,
, 与NaCN发生反应生成
与NaCN发生反应生成 ,
, 先与氢氧化钠发生反应①,然后酸化得到苯乙酸,最后苯乙酸与乙醇在浓硫酸作用下得到苯乙酸乙酯,该合成流程为:
先与氢氧化钠发生反应①,然后酸化得到苯乙酸,最后苯乙酸与乙醇在浓硫酸作用下得到苯乙酸乙酯,该合成流程为: ,
,
故答案为: .
.
点评 本题考查了有机合成,题目难度较大,明确合成原理为解答关键,注意熟练掌握常见有机物结构与性质,(4)同分异构体的书写和(5)合成流程为难点,要求学生明确同分异构体的书写原则及题中信息反应原理,试题充分培养了学生灵活应用基础知识的能力及逻辑推理能力.

 全能测控一本好卷系列答案
全能测控一本好卷系列答案 已知:pAg=-lg[c(Ag+)],Ksp(AgCl)=1.8×10-10,且Ksp(AgCl)>Ksp(AgI).如图是向10mL AgNO3溶液中逐渐加入0.1mol/L的NaCl溶液时,溶液的pAg随着加入NaCl溶液的体积(单位mL)变化的图象(实线).根据图象所得下列结论正确的是( )
已知:pAg=-lg[c(Ag+)],Ksp(AgCl)=1.8×10-10,且Ksp(AgCl)>Ksp(AgI).如图是向10mL AgNO3溶液中逐渐加入0.1mol/L的NaCl溶液时,溶液的pAg随着加入NaCl溶液的体积(单位mL)变化的图象(实线).根据图象所得下列结论正确的是( )| A. | 原AgNO3溶液的物质的量浓度为0.1 mol•L-1 | |
| B. | 图中X点的坐标为(10,6) | |
| C. | 图中X点对应溶液中Ag+与Cl-的浓度不相同 | |
| D. | 若把0.1 mol•L-1的NaCl溶液换成0.1 mol•L-1的NaI溶液,则图象在终点后变为虚线部分 |
| A. | 酸、碱、盐都是电解质 | |
| B. | H2O与D2O互称同素异形体 | |
| C. | 石油的分馏和裂化均属于化学变化 | |
| D. | 只含共价键的物质,一定是共价化合物 |
(1)铁原子在基态时,价电子(外围电子)排布式为3d64s2.
(2)硝酸钾中NO3-空间构型为平面三角形,写出与NO3-为等电子体的一种非极性分子化学式BF3[SO3(g)、BBr3等].
(3)6-氨基青霉烷酸的结构如图1所示,其中采用sp3杂化的原子有C、N、O、S.

(4)下列说法正确的有a(填字母序号).
a.乙醇分子间可形成氢键,导致其沸点比氯乙烷高
b.钨的配合物离子[W(CO)5OH]-能催化固定CO2,该配离子中钨显-1价
c.聚乙烯分子中有5n个σ键
d.由下表中数据可确定在反应Si(s)+O2(g)═SiO2(s)中,每生成60g SiO2放出的能量为(2c-a-b)kJ
| 化学键 | Si-Si | O═O | Si-O | |
| 键能(kJ•mol-1) | a | b | c | |
(6)铜元素与氢元素形成的一种红色离子化合物,其晶体结构如图2所示.则该晶体的化学式为CuH,密度为$\frac{6×65}{\frac{3\sqrt{3}}{2}a{b}^{2}×1{0}^{-30}{N}_{A}}$g.cm-3(列式即可,阿佛加特罗定律常数的值用NA表示)
| A. | 在pH=4的溶液中,水所电离出的总的c(OH-)是10-10 mol•L-1 | |
| B. | 将pH=2的酸溶液和pH=12的碱溶液等体积混合后溶液的pH=7 | |
| C. | 将pH=4的盐酸和pH=4的醋酸分别与足量NaHCO3反应,后者产生CO2多 | |
| D. | 将pH=4醋酸和pH=10的氢氧化钠任意比例混合:c(Na+)+c(H+)=c(OH-)+c(CH3COO-) |
| A. | 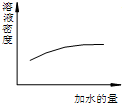 浓硫酸的稀释 浓硫酸的稀释 | |
| B. | 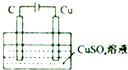 某电极上有铜产生,且溶液中铜离子浓度不变 | |
| C. |  微粒电子数 微粒电子数 | |
| D. | 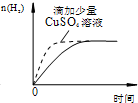 过量的盐酸和等量的锌粉反应 过量的盐酸和等量的锌粉反应 |
| A. | 用FeCl3溶液腐蚀印刷电路板:Fe3++Cu═Fe2++Cu2+ | |
| B. | AlCl3溶液中加过量氨水:Al3++4NH3•H2O═AlO2-↓+4NH4++2H2O | |
| C. | 小苏打置于盐酸中:CO32-+2H+═CO2↑+H2O | |
| D. | 过量CO2通入漂白粉溶液中:CO2+H2O+ClO-═HCO3-+HClO |
 ;
;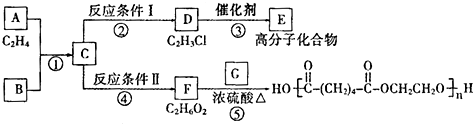
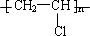 ,GHOOC(CH2)4COOH;
,GHOOC(CH2)4COOH;