题目内容
18.在人类文明的历程中,改变世界的事物很多,其中铁、硝酸钾、青霉素、氨、乙醇、二氧化碳、聚乙烯、二氧化硅等多种“分子”改变过人类的世界.(1)铁原子在基态时,价电子(外围电子)排布式为3d64s2.
(2)硝酸钾中NO3-空间构型为平面三角形,写出与NO3-为等电子体的一种非极性分子化学式BF3[SO3(g)、BBr3等].
(3)6-氨基青霉烷酸的结构如图1所示,其中采用sp3杂化的原子有C、N、O、S.

(4)下列说法正确的有a(填字母序号).
a.乙醇分子间可形成氢键,导致其沸点比氯乙烷高
b.钨的配合物离子[W(CO)5OH]-能催化固定CO2,该配离子中钨显-1价
c.聚乙烯分子中有5n个σ键
d.由下表中数据可确定在反应Si(s)+O2(g)═SiO2(s)中,每生成60g SiO2放出的能量为(2c-a-b)kJ
| 化学键 | Si-Si | O═O | Si-O | |
| 键能(kJ•mol-1) | a | b | c | |
(6)铜元素与氢元素形成的一种红色离子化合物,其晶体结构如图2所示.则该晶体的化学式为CuH,密度为$\frac{6×65}{\frac{3\sqrt{3}}{2}a{b}^{2}×1{0}^{-30}{N}_{A}}$g.cm-3(列式即可,阿佛加特罗定律常数的值用NA表示)
分析 (1)Fe为26号元素,其3d、4s能级上电子为其价电子;
(2)硝酸根离子中N原子价层电子对个数是3且不含孤电子对,根据价层电子对互斥理论判断空间构型;原子个数相等、价电子数相等的微粒互为等电子体;
(3)价层电子对个数是4的原子采用sp3杂化;
(4)a.分子间氢键导致物质熔沸点升高;
b.钨的配合物离子[W(CO)5OH]-中W为0价;
c.聚乙烯(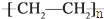 )分子中有(6n-1)个σ键;
)分子中有(6n-1)个σ键;
d.60gSiO2的物质的量=$\frac{60g}{60g/mol}$=1mol,一个硅原子含有4个硅氧键;
(5)①从电负性上看,氧与氢的电负性大于氧与氟的电负性差值;
②OF2中氧原子上有两对孤电子对,抵消了F-O键中共用电子对偏向F而产生的极性.(2分)
(5)从电负性上看,氧与氢的电负性大于氧与氟的电负性差值;
OF2中氧原子上有两对孤电子对,抵消了F-O键中共用电子对偏向F而产生的极性;
(6)该晶胞中Cu原子个数=3+2×$\frac{1}{2}$+12×$\frac{1}{6}$=6,H原子个数=1+3+6×$\frac{1}{3}$=6;密度=$\frac{m}{V}$.
解答 解:(1)铁是26号元素,基态原子核外有26个电子,3d、4s能级上电子是其价电子,根据构造原理知其价电子排布式为:3d64s2,故答案为:3d64s2;
(2)NO3-中N原子价层电子对=3+$\frac{1}{2}$(5+1-3×2)=3,且不含孤电子对,所以是平面三角形结构,
与N03-互为等电子体的一种非极性分子有:BF3[SO3( g)、BBr3等],
故答案为:平面正三角形;BF3[SO3( g)、BBr3等];
(3)只要共价单键和孤电子对的和是4的原子就采取sp3杂化,根据图片知,采用sp3杂化的原子有C、N、O、S,故答案为:C、N、O、S;
(4)a.乙醇分子间可形成氢键,氯乙烷中不含氢键,氢键的存在导致乙醇的沸点升高,所以乙醇的沸点比氯乙烷高,故正确;
b.根据化合物中化合价的代数和为0知,钨的配合物离子[W(CO)5OH]-中钨显0价,故错误;
c.聚乙烯(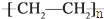 )分子中有(6n-1)个σ键,故错误;
)分子中有(6n-1)个σ键,故错误;
d.由表中数据知反应Si(s)+O2(g)=SiO2(s)中,每生成60gSiO2放出的能量为(4c-2a-b)kJ,故错误;
故选a;
(5)从电负性上看,氧与氢的电负性大于氧与氟的电负性差值;OF2中氧原子上有两对孤电子对,抵消了F-O键中共用电子对偏向F而产生的极性,从而导致H2O分子的极性很强,而OF2分子的极性却很小,
故答案为:从电负性上看,氧与氢的电负性大于氧与氟的电负性差值;OF2中氧原子上有两对孤电子对,抵消了F-O键中共用电子对偏向F而产生的极性,从而导致H2O分子的极性很强;
(6)该晶胞中Cu原子个数=3+2×$\frac{1}{2}$+12×$\frac{1}{6}$=6,H原子个数=1+3+6×$\frac{1}{3}$=6,该晶胞中Cu、H原子个数之比为6:6=1:1,所以其化学式为CuH;
该晶胞底面中一个小三角形面积=($\frac{1}{2}$×b×10-10×$\frac{\sqrt{3}}{2}b$×10-10)cm2,则一个小三棱柱体积=($\frac{1}{2}$×b×10-10×$\frac{\sqrt{3}}{2}b$×10-10)cm2×a×10-10cm,该晶胞体积=6×($\frac{1}{2}$×b×10-10×$\frac{\sqrt{3}}{2}b$×10-10)cm2×a×10-10cm=
$\frac{3\sqrt{3}}{2}a{b}^{2}×1{0}^{-30}$ cm3,
密度=$\frac{m}{V}$=$\frac{\frac{65}{{N}_{A}}×6}{V}$=$\frac{6×65}{\frac{3\sqrt{3}}{2}a{b}^{2}×1{0}^{-30}{N}_{A}}$g/cm3,
故答案为:CuH; $\frac{6×65}{\frac{3\sqrt{3}}{2}a{b}^{2}×1{0}^{-30}{N}_{A}}$.
点评 本题考查物质结构和性质,为高频考点,侧重考查学生知识运用及计算能力、空间想象能力,难点是(6)晶胞计算,正确计算晶胞体积是解(6)题关键,题目难度中等.

| 6种一溴二甲苯的熔点/℃ | 234 | 206 | 213.8 | 204 | 214.5 | 205 |
| 对应二甲苯的熔点/℃ | 13 | -54 | -27 | -54 | -27 | -54 |
| A. |  | B. |  | C. |  | D. |  |
| A. | 在熔融电解质中,O2-向正极定向移动 | |
| B. | 通入丁烷的一极是负极,电极反应为:C4H10+26e-+13O2-═4CO2↑+5H2O | |
| C. | 通入空气的一极是正极,电极反应为:O2+4e-═2O2- | |
| D. | 电池的总反应是:2C4H10+13O2═8CO2+10H2O |

| A. | 化学式为C6H6O6 | |
| B. | 乌头酸能使酸性高锰酸钾溶液或溴水褪色 | |
| C. | 乌头酸能发生水解反应和加成反应 | |
| D. | 含l mol乌头酸的溶液最多可消耗3 mol NaOH |
| A. | HD、H2O、NH3均为化合物 | |
| B. | CH2O2、C3H6O2、C4H8O2一定互为同系物 | |
| C. | HCOOCH3、CH3COOH、HOCH2CHO互为同分异构体 | |
| D. | SiO2、NaCl、S8、Cu均是能表示物质分子组成的分子式 |
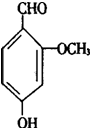 它有宜人的气味,存在于香草豆、香脂、安息香、丁子油和香茅油中,是制作巧克力的辅助原料,下列关于香兰素的判断不正确的是( )
它有宜人的气味,存在于香草豆、香脂、安息香、丁子油和香茅油中,是制作巧克力的辅助原料,下列关于香兰素的判断不正确的是( )| A. | 可与银氨溶液反应 | B. | 可与氢氧化钠溶液反应 | ||
| C. | 可与浓溴水发生取代反应 | D. | 分子中所有原子都在同一平面 |
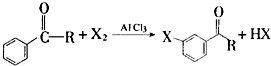


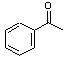 +Br2$\stackrel{AlCl_{3}}{→}$
+Br2$\stackrel{AlCl_{3}}{→}$ +HBr
+HBr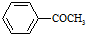 的符合以下条件的同分异构体还有4种(不包括原料本身),条件:结构中必须含有苯环和
的符合以下条件的同分异构体还有4种(不包括原料本身),条件:结构中必须含有苯环和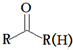 ,其中核磁共振氢谱图中共有5个吸收峰的分子的结构简式为
,其中核磁共振氢谱图中共有5个吸收峰的分子的结构简式为
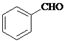 )和乙醇为原料合成苯乙酸乙酯,如图
)和乙醇为原料合成苯乙酸乙酯,如图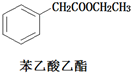 :
: