题目内容
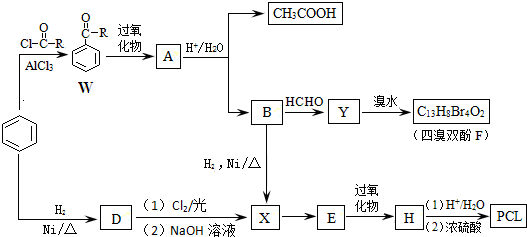
19.图1是Na、Cu、Si、H、C、N等元素单质的熔点高低的顺序,其中c、d均是热和电的良导体.
①图中d单质的晶体堆积方式类型是面心立方最密堆积.
②图2是上述六种元素中的一种元素形成的含氧酸的结构,请简要说明该物质易溶于水的原因:硝酸分子是极性分子,易溶于极性溶剂的水中,硝酸分子中氢氧键易与水分子间形成氢键.
分析 ①一般来说,分子晶体的熔点较小,金属晶体的熔点较大,原子晶体的熔点最高,金属为热和电的良导体,c、d均是热和电的良导体,则c和d是金属,钠的熔点小于铜,所以d是铜,根据铜的晶胞结构确定其堆积方式;
②根据图知,该含氧酸中含有羟基,羟基和水中氧原子易形成氢键.
解答 解:①d单质是热和电的良导体,且熔点较高,则为铜,铜为面心立方最密堆积,故答案为:面心立方最密堆积;
②根据图知,该分子中含有一个氢原子、三个氧原子和一个氮原子,为硝酸分子,硝酸分子正负电荷重心不重合,为极性分子,且硝酸和水能形成氢键而增大硝酸的溶解性,故答案为:硝酸分子是极性分子,易溶于极性溶剂的水中,硝酸分子中氢氧键易与水分子间形成氢键.
点评 本题考查了金属的堆积方式、氢键等知识点,根据物质的熔点及导电性确定物质,再结合物质的结构、晶体类型、氢键对物质溶解性的影响来分析解答,难度不大.

练习册系列答案
相关题目
10.下列说法不正确的是( )
| A. | 合成高效、稳定、廉价的太阳能光电转化材料,是开发利用太阳能的关键 | |
| B. | 大量焚烧田间秸秆会产生雾霾,“雾”和“霾”的分散质微粒不同 | |
| C. | 肥皂能去污的原理,是其在水溶液中能电离出钠离子(亲水基团)和硬脂酸根离子(亲油基团),在它们的共同作用下,通过搓洗,将衣服上的油污“拖下水” | |
| D. | 我国已能利用3D打印技术,以钛合金粉末为原料,通过激光熔化逐层堆积,来制造飞机钛合金结构件,高温时可用金属钠还原相应的氯化物来制取金属钛 |
7.铁-镍蓄电池充电放电时发生的反应为:Fe+NiO2+2H2O$?_{充电}^{放电}$Fe(OH)2+Ni(OH)2,关于此蓄电池的下列说法中不正确的是( )
| A. | 放电时负极附近溶液的碱性不变 | |
| B. | 充电时阴极的电极反应式为Ni(OH)2═NiO2+2H++2e- | |
| C. | 放电时NiO2的反应为NiO2+2e-+2H2O═Ni(OH)2+2OH- | |
| D. | 利用蓄电池电解饱和食盐水,阳极产生标准状况下8.4LCl2,则理论上电路中通过电子物质的量为0.75mol |
14.短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T是地壳含量最多的金属元素,W所处的周期序数是其原子最外层电子数的一半.
(1)R的原子结构示意图是 ,用化学方程式表示工业上常用于冶炼T单质的原理是2Al2O3$\frac{\underline{\;通电\;}}{\;}$4Al+3O2↑.
,用化学方程式表示工业上常用于冶炼T单质的原理是2Al2O3$\frac{\underline{\;通电\;}}{\;}$4Al+3O2↑.
(2)元素的非金属性:Q弱于W(填“强于”或“弱于”),简述其原因是最高价氧化物对应水化物碳酸是弱酸而硫酸是强酸.
(3)元素X与T同周期,且在该周期中原子半径最大,请写出X的最高价氧化物的水化物与T的最高价氧化物的水化物反应的离子方程式OH-+Al(OH)3=AlO2-+2H2O.
| Q | R | ||
| T | W |
 ,用化学方程式表示工业上常用于冶炼T单质的原理是2Al2O3$\frac{\underline{\;通电\;}}{\;}$4Al+3O2↑.
,用化学方程式表示工业上常用于冶炼T单质的原理是2Al2O3$\frac{\underline{\;通电\;}}{\;}$4Al+3O2↑.(2)元素的非金属性:Q弱于W(填“强于”或“弱于”),简述其原因是最高价氧化物对应水化物碳酸是弱酸而硫酸是强酸.
(3)元素X与T同周期,且在该周期中原子半径最大,请写出X的最高价氧化物的水化物与T的最高价氧化物的水化物反应的离子方程式OH-+Al(OH)3=AlO2-+2H2O.
4.下列有关叙述中正确的是( )
| A. | 煤经过气化和液化两个物理变化,可变为清洁能源 | |
| B. | 葡萄糖可以制乙醇,两者都能与金属钠反应 | |
| C. | 明矾可用于水的消毒、杀菌;碳酸钡可用于钡餐透视 | |
| D. | 合成纤维和光导纤维都是有机高分子化合物 |
8.下列反应的离子方程式中正确的是( )
| A. | 稀硝酸与过量的铁屑反应:3Fe+8H++2NO3-=3Fe3++2NO↑+4H2O | |
| B. | 硫酸铝溶液与过量的氨水反应:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| C. | 苯酚钠的水溶液中通入少量的CO2:2C6H5O?+CO2+H2O→2C6H5OH+CO32- | |
| D. | 醋酸钠的水解反应:CH3COO-+H3O+=CH3COOH+H2O |
3.在HNO2溶液中存在如下平衡:HNO2?H++NO2-,向该溶液中加入少量的下列物质后,能使电离平衡向右移动且使H+增多的是( )
| A. | 水 | B. | NaOH溶液 | C. | NaNO2溶液 | D. | HNO3 |
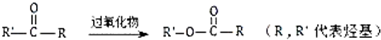
 .
. .
. .
. .
. .
. .
.