18.牙膏生产中要填充少量甘油,主要是因为甘油( )
| A. | 有甜味 | B. | 能防潮 | C. | 吸湿性强 | D. | 能杀菌消毒 |
17.某地污水中含有Zn2+、Hg2+、Fe3+、Cu2+四种阳离子.甲、乙、丙三位同学设计的从该污水中回收金属铜的方案如下:
甲:污水$→_{①}^{+NaOH溶液,过滤}$沉淀$→_{②}^{△}$ CuO$→_{③}^{+H_{2}△}$ Cu
乙:污水$→_{①}^{+过量铁粉,过滤}$滤渣$→_{②}^{△}$CuO$→_{③}^{+H_{2}△}$ Cu
丙:污水$→_{①}^{+过量铁粉,过滤}$滤渣$→_{②}^{+稀盐酸,过滤}$滤渣$→_{③}^{△}$CuO$→_{④}^{+H_{2},△}$Cu
下列判断正确的是( )
甲:污水$→_{①}^{+NaOH溶液,过滤}$沉淀$→_{②}^{△}$ CuO$→_{③}^{+H_{2}△}$ Cu
乙:污水$→_{①}^{+过量铁粉,过滤}$滤渣$→_{②}^{△}$CuO$→_{③}^{+H_{2}△}$ Cu
丙:污水$→_{①}^{+过量铁粉,过滤}$滤渣$→_{②}^{+稀盐酸,过滤}$滤渣$→_{③}^{△}$CuO$→_{④}^{+H_{2},△}$Cu
下列判断正确的是( )
| A. | 三种实验方案都能制得纯净的铜 | |
| B. | 乙方案中加过量铁粉可以将四种阳离子全部还原 | |
| C. | 甲方案中的反应涉及置换、分解、化合、复分解四种反应类型 | |
| D. | 丙方案会产生环境污染 |
15.下表列出部分化学键的键能:
据此判断下列说法正确的是( )
| 化学键 | Si-O | Si-Cl | H-H | H-Cl | Si-Si | Si-C | Cl-Cl |
| 键能/kJ•mol-1 | 460 | 360 | 436 | 431 | 176 | 347 | 243 |
| A. | 表中最稳定的共价键是Si-Si | |
| B. | Cl2(g)→2 Cl(g):△H=-243 kJ•mol | |
| C. | H2 (g)+Cl2(g)=2HCl(g):△H=-183 kJ•mol | |
| D. | 根据表中数据能计算出SiCl4(g)+2 H2(g)=Si(s)+4 HCl(1)的△H |
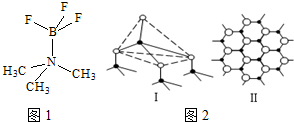
12.由Li、Al、Si构成的某三元化合物固态晶体结构如图所示,下列说法正确的是( )

| A. | 该化合物化学式可表示为LiAlSi | |
| B. | 晶体中Al和Li构成CsCl型骨架 | |
| C. | 晶体中Al和Si构成金刚石型骨架 | |
| D. | 晶体中与每个Al距离最近的Li为4个 |
11. 对硫-氮化合物的研究是现代无机化学最为活跃的领域之一,如图是已经合成的最著名的硫-氮化合物的分子结构.下列关于该物质说法正确的是( )
对硫-氮化合物的研究是现代无机化学最为活跃的领域之一,如图是已经合成的最著名的硫-氮化合物的分子结构.下列关于该物质说法正确的是( )
 对硫-氮化合物的研究是现代无机化学最为活跃的领域之一,如图是已经合成的最著名的硫-氮化合物的分子结构.下列关于该物质说法正确的是( )
对硫-氮化合物的研究是现代无机化学最为活跃的领域之一,如图是已经合成的最著名的硫-氮化合物的分子结构.下列关于该物质说法正确的是( )| A. | 分子式为SN | |
| B. | 分子中既有极性键又有非极性键 | |
| C. | 分子中所有共价键的键长一定相等 | |
| D. | 该物质与化合物S2N2互为同素异形体 |
10.下列判断正确的是( )
| A. | 第一电离能:Al<Mg | B. | 共价键极性:H-F<H-Cl | ||
| C. | 硬度:Al2O3<NaCl | D. | 酸性:H2SO4>H2SO3 |
9.以NA表示阿伏加德罗常数的值,下列说法错误的是( )

0 168616 168624 168630 168634 168640 168642 168646 168652 168654 168660 168666 168670 168672 168676 168682 168684 168690 168694 168696 168700 168702 168706 168708 168710 168711 168712 168714 168715 168716 168718 168720 168724 168726 168730 168732 168736 168742 168744 168750 168754 168756 168760 168766 168772 168774 168780 168784 168786 168792 168796 168802 168810 203614

| A. | 18g冰(图1)中含O-H键数目为2NA | |
| B. | 28g晶体硅(图2)中含有Si-Si键数目为2NA | |
| C. | 44g干冰(图3)中含有NA个晶胞结构单元 | |
| D. | 石墨烯(图4)是碳原子单层片状新材料,12g石墨烯中含C-C键数目为1.5NA |