题目内容
11. 对硫-氮化合物的研究是现代无机化学最为活跃的领域之一,如图是已经合成的最著名的硫-氮化合物的分子结构.下列关于该物质说法正确的是( )
对硫-氮化合物的研究是现代无机化学最为活跃的领域之一,如图是已经合成的最著名的硫-氮化合物的分子结构.下列关于该物质说法正确的是( )| A. | 分子式为SN | |
| B. | 分子中既有极性键又有非极性键 | |
| C. | 分子中所有共价键的键长一定相等 | |
| D. | 该物质与化合物S2N2互为同素异形体 |
分析 A.该分子中含有4个N原子、4个S原子;
B.同种非金属元素之间易形成非极性键,不同非金属元素之间易形成极性键;
C.共价键的键长与原子半径成正比;
D.同种元素的不同单质互为同素异形体.
解答 解:A.该分子中含有4个N原子、4个S原子,其化学式为S4N4,故A错误;
B.同种非金属元素之间易形成非极性键,不同非金属元素之间易形成极性键,N-S原子之间存在极性键、S-S原子之间存在非极性键,故B正确;
C.共价键的键长与原子半径成正比,所以键长S-S>S-N,故C错误;
D.同种元素的不同单质互为同素异形体,S4N4和S2N2都是化合物不是单质,所以不是同素异形体,故D错误;
故选B.
点评 本题考查分子晶体、化学键、键长、同素异形体等基本概念,明确概念内涵是解本题关键,知道同素异形体、同位素、同分异构体概念之间的差别,知道键长大小比较方法,题目难度不大.

练习册系列答案
 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案
相关题目
8.下列说法正确的是( )


| A. | 在常温下,0.10mol•L-1Na2CO3溶液25mL 用0.10mol•L-1盐酸滴定.当滴定到消耗20mlHCl时所得溶液中离子浓度间的关系有:5c(Cl-)═4c(HCO3-)+4c(CO32-)+4c(H2CO3) | |
| B. | 常温下物质的量浓度相等的①(NH4)2CO3 ②(NH4)2SO4③(NH4)2Fe(SO4)2三种溶液中水的电离程度:③>①>② | |
| C. | 常温下醋酸和醋酸钠混合溶液中c(CH3COOH)、c(CH3COO-)与pH值的关系如图所示,当pH=4.5溶液中:C(CH3COO-)>C(CH3COOH)>C(H+)>C(OH-) | |
| D. | 等体积等物质的量浓度的NaF溶液与NaCl溶液中离子总数:N(NaF)>N(NaCl) |
7.已知某饱和一元醇分子中含m个-CH2-,n个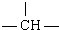 一个-OH,其余为甲基,则甲基个数为( )
一个-OH,其余为甲基,则甲基个数为( )
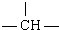 一个-OH,其余为甲基,则甲基个数为( )
一个-OH,其余为甲基,则甲基个数为( )| A. | 2n+3m-1 | B. | m+n-1 | C. | n+2m+1 | D. | n+1 |
6.下列有机化合物中含有手性碳原子的是( )
| A. | 乙醇(CH3CH2OH) | B. | 甘油(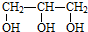 ) ) | C. | 乳酸(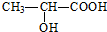 ) ) | D. | 苯乙烯(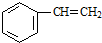 ) ) |
3.下列有机物:①苯酚②苯甲醇③乙酸④碳酸,酸性由强到弱的是( )
| A. | ①>②>③>④ | B. | ③>①>②>④ | C. | ③>④>①>② | D. | ③>①>④>② |
20.下列反应过程中能量变化符合如图所示的是( )
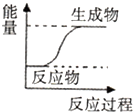

| A. | C+C02 $\frac{\underline{\;高温\;}}{\;}$2CO | B. | Zn+H2S04=ZnS04+H2↑ | ||
| C. | CH4+202$\stackrel{点燃}{→}$C02+2H20 | D. | K0H+HN03=KN03+H20 |

 ,B、C可形成离子化合物B3C2,E是同周期元素中原子半径最小的元素.
,B、C可形成离子化合物B3C2,E是同周期元素中原子半径最小的元素. .
.