题目内容
14.氮(N)元素与多种元素可以形成多种化合物.(1)NH4Cl受热分解时克服的化学键有离子键、共价键;NH4Cl晶体不能导电的原因是阴阳离子不能自由移动.
(2)N、H元素除了可以形成10电子分子NH3外,还可形成18电子分子肼,肼的结构简式为NH2-NH2.若将肼分子中的2个H原子替换为甲基(-CH3),所得分子的结构简式可能为NH2N(CH3)2、H3CNHNHCH3.
(3)平面型BF3很容易与特定化合物[如N(CH3)3]以配位键形成四面体配位化合物,请在下图1中用“→”标出B、N原子间存在的配位键.
(4)氮化硼(BN)是一种新型无机非金属材料,氮化硼有两种重要晶型A型和B型.A型氮化硼硬度很高,是特殊的耐磨和切削材料;B型氮化硼化学稳定性较好,是一种优良的润滑剂.A型氮化硼结构下图2中I(选填“I”或“Ⅱ”)所示.工业上氮化硼以三氯化硼、氢气、氮气为原料,在高温条件下反应制得,写出该反应的化学方程式2BCl3+N2+3H2$\frac{\underline{\;高温\;}}{\;}$2BN+6HCl.
(5)氢氧化铜与氨水 形成铜氨溶液,已知[Cu(NH3)4]2+中的两个NH3被两个Cl-取代,能得到两种不同结构的产物,则[Cu(NH3)4]2+的空间构型为平面四边形(选填“平面四边形”或“正四面体”).[Cu(NH3)2]+在空气中立即转化为深蓝色的[Cu(NH3)4]2+,简述发生转化的可能原因[Cu(NH3)2]+被空气中的氧气氧化为深蓝色的[Cu(NH3)4]2+.
(6)向[Cu(NH3)4]SO4溶液中通入SO2至微酸性,有白色沉淀生成.该沉淀包含一种正四面体型的阳离子和一种三角锥型的阴离子,摩尔质量为162g/mol,且Cu、S、N的物质的量之比为1:1:1,则该白色沉淀的化学式为(NH4)CuSO3.

分析 (1)NH4Cl为离子化合物,含有离子键和共价键,在溶液或熔融状态下电离出自由移动的离子,可导电;
(2)若将肼分子中的2个H原子替换为甲基(-CH3),可取代同一N原子上的H或不同N原子上的H原子;
(3)B最外层有3个电子,与3个F全部成键,含有空轨道,可与N提供的电子对形成配位键;
(4)A型氮化硼硬度很高,是特殊的耐磨和切削材料,应具有空间结构,B为平面结构;工业上氮化硼以三氯化硼、氢气、氮气为原料,在高温条件下反应制得,同时生成HCl;
(5)[Cu(NH3)4]2+中的两个NH3被两个Cl-取代,能得到两种不同结构的产物,应为平面结构;[Cu(NH3)2]+中Cu元素化合价为+1价,易被氧化而变质;
(6)根据构成元素、各元素的物质的量之比、阴阳离子的空间构型确定沉淀的化学式.
解答 解:(1)NH4Cl为离子化合物,含有离子键和共价键,NH4Cl晶体不含自由移动的离子,不能导电,
故答案为:离子键、共价键;阴阳离子不能自由移动;
(2)若将肼分子中的2个H原子替换为甲基(-CH3),可取代同一N原子上的H,生成NH2N(CH3)2,取代不同N原子上的H原子,生成H3CNHNHCH3,
故答案为:NH2N(CH3)2;H3CNHNHCH3;
(3)B最外层有3个电子,与3个F全部成键,含有空轨道,可与N提供的电子对形成配位键,如图 ,故答案为:
,故答案为: ;
;
(4)A型氮化硼硬度很高,是特殊的耐磨和切削材料,应具有空间结构,类似于金刚石的结构和性质,B为平面结构,是一种优良的润滑剂,类似于石墨的结构和性质,工业上氮化硼以三氯化硼、氢气、氮气为原料,在高温条件下反应制得,同时生成HCl,反应的方程式为2BCl3+N2+3H2$\frac{\underline{\;高温\;}}{\;}$2BN+6HCl,
故答案为:I;2BCl3+N2+3H2$\frac{\underline{\;高温\;}}{\;}$2BN+6HCl;
(5)[Cu(NH3)4]2+中的两个NH3被两个Cl-取代,能得到两种不同结构的产物,应为平面结构,如为正四面体,则存在不同结构,[Cu(NH3)2]+中Cu元素化合价为+1价,易被氧化而变质,
故答案为:平面四边形;[Cu(NH3)2]+被空气中的氧气氧化为深蓝色的[Cu(NH3)4]2+;
(6)该沉淀中Cu、S、N的物质的量之比为1:1:1,经测定该沉淀的晶体里有一种三角锥型的阴离子为亚硫酸根离子,一种正四面体型的阳离子为铵根离子,再根据化合物中各元素的化合价代数和为0及元素守恒知,该沉淀中还含有+1价Cu,所以其化学式为:(NH4)CuSO3,
故答案为:(NH4)CuSO3.
点评 本题综合考查原子结构和性质,为高考常见题型,能很好的培养学生的分析能力和自学能力,答题时注意把握题给信息,注意把握晶体的结构和性质,难度中等.

| 元素 | 相关信息 |
| X | 元索周期表中核电荷数最小的元素 |
| Y | Y的一种核素常用于考古,其一种同素异形体为自然界最硬的物质 |
| Z | Z是大气中含量最多的元素,其某些氧化物为大气中常见的污染物 |
| W | W是地壳中含量最高的金属元素 |
| M | 常见金属,单质呈紫红色 |
(2)Z原子的第一电离能比氧原子的大(填“大”或“小”);M的基态原子价电子排布式是3d104s1.
(3)X与Y可形成多种化合物,其中常用来切割或焊接金属的气体分子中σ键和π键之比是3:2,空间构型是直线形.
(4)X与Z形成的最简单化合物用途非常广泛,试列举两种用途:制硝酸、作制冷剂;该化合物具有较强的还原性,加热时能将M的氧化物MO还原,写出该反应的化学方程式:3CuO+2NH3$\frac{\underline{\;\;△\;\;}}{\;}$3Cu+N2↑+3H2O.
(5)可用YX4还原ZOx以消除其污染.已知:
YX4 (g)+4ZO2 (g)═4ZO2(g)+YO2(g)+2X2O(g)△H=-574kJ•mol-1
YX4 (g)+4ZO(g)═2Z2 (g)十YO2 (g)+2X2O(g)△H=-1160kJ•mol-1
试写出用YX4还原ZO2至Z2的热化学方程式:CH4 (g)+2NO2 (g)=CO2(g)+N2 (g)+2H2O(g)△H=-867kJ•mol-1.
| A. | 石墨和稀硫酸 | B. | 金属铝和金属铜 | ||
| C. | 金刚石和晶体硅 | D. | 液态HCl和液态NaCl |

| A. | 18g冰(图1)中含O-H键数目为2NA | |
| B. | 28g晶体硅(图2)中含有Si-Si键数目为2NA | |
| C. | 44g干冰(图3)中含有NA个晶胞结构单元 | |
| D. | 石墨烯(图4)是碳原子单层片状新材料,12g石墨烯中含C-C键数目为1.5NA |
| A. | 苯甲酸钠 | B. | 瘦肉精 | C. | 三聚氰胺 | D. | 甲醇 |
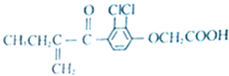
| A. | 分子中有4个碳碳双键 | |
| B. | 该有机物能发生银镜反应 | |
| C. | 既能发生还原反应,又能发生氧化反应 | |
| D. | 1mol该物质最大跟6mol氢气发生反应 |
| A. | 醋酸溶液作导电试验,灯光较暗 | |
| B. | 醋酸(CH3COOH)是共价化合物 | |
| C. | 醋酸不与氯化钠反应 | |
| D. | 常温下1mol.L-1醋酸溶液的c(H+)约为0.004mol•L-1 |
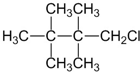
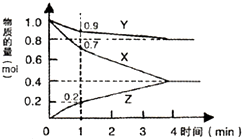 (1)某温度时,2L的密闭容器中X、Y、Z=种气体物质的物质的量随时间的变化如图 所示.
(1)某温度时,2L的密闭容器中X、Y、Z=种气体物质的物质的量随时间的变化如图 所示.