4.在下列溶液中,各组粒子一定能够大量共存的是( )
| A. | 在$\frac{c({H}^{+})}{c(O{H}^{-})}$=1012的溶液中:Fe2+、Mg2+、NO3-、Cl- | |
| B. | 使甲基橙变红的溶液中:NH4+、Al3+、NO3-、Cl- | |
| C. | 澄清透明的溶液中:ClO-、MnO4-、Al3+、CH3CH2OH | |
| D. | 0.1mol/L的氯化铁溶液中:Na+、SO42-、Cl-、C6H5OH |
3.设NA为阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 28 g由C2H4和C3H6组成的混合物中含有氢原子的数目为4 NA | |
| B. | l mol Fe(NO3)3与足量HI溶液反应时转移的电子数为3NA | |
| C. | 1 mol Na2O2固体中含离子总数为4NA | |
| D. | 在标准状况下,11.2L NO2所含电子数为11.5NA |
1.下列有关化学用语使用正确的是( )
| A. | 次氯酸的电子式: | |
| B. | 乙烯的结构简式:CH2CH2 | |
| C. | S2-离子的结构示意图: | |
| D. | CS2的与CO2都是直线型分子,则CS2的比例模型为 |
20.某有机物的结构简式如图所示,下列有关该有机物的说法正确的是( )
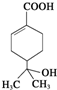

| A. | 分子中含有两种官能团 | |
| B. | 可使溴水和酸性高锰酸钾溶液褪色,且原理相同 | |
| C. | 能发生加成、取代、氧化、消去等反应 | |
| D. | 与钠和氢氧化钠溶液都能发生反应,且得到的产物相同 |
19.下列有关离子方程式正确的是( )
| A. | 向稀盐酸中加入少量钠粒:2Na+2H2O=2Na++2OH-+H2↑ | |
| B. | 将NaHSO4与Ba(OH)2溶液混合至中性:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O | |
| C. | 用漂白粉溶液吸收尾气中SO2:Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO | |
| D. | 往KAl(SO4)2溶液中滴入Ba(OH)2溶液至沉淀的物质的量最大:Al3++2SO42-+2Ba2++4OH-═AlO2-+2BaSO4↓+2H2O |
18.几种短周期元素的原子半径及主要化合价如表所示:
下列叙述正确的是( )
| 元素代号 | X | Y | Z | W |
| 原子半径/pm | 160 | 143 | 70 | 66 |
| 主要化合价 | +2 | +3 | +5.+3.-3 | -2 |
| A. | X.Y元素的金属性:X<Y | |
| B. | 一定条件下,Z单质与W的常见单质直接生成ZW2 | |
| C. | 一定条件下,W单质可以将Z单质从其氢化物中置换出来 | |
| D. | Y的最高价氧化物对应的水化物能溶于稀氨水 |
17.下列有关818O2的说法正确的是( )
0 168608 168616 168622 168626 168632 168634 168638 168644 168646 168652 168658 168662 168664 168668 168674 168676 168682 168686 168688 168692 168694 168698 168700 168702 168703 168704 168706 168707 168708 168710 168712 168716 168718 168722 168724 168728 168734 168736 168742 168746 168748 168752 168758 168764 168766 168772 168776 168778 168784 168788 168794 168802 203614
| A. | 816O2是818O2的同分异构体 | B. | 818O2是O3的一种同素异形体 | ||
| C. | 816O2与818O2互为同位素 | D. | 1mol 818O2分子中含有20mol电子 |
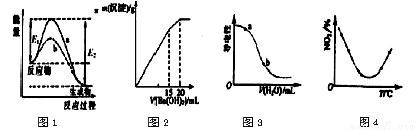
 N2O4(g),相同时间间后测得NO2含量的曲线,则该反应的△H<0
N2O4(g),相同时间间后测得NO2含量的曲线,则该反应的△H<0
 某研究性学习小组的同学通过对亚硫酸钠组成元素的价态进行分析后认为Na2SO3溶液在存放过程中有可能变质,若已变质,则相应反应的化学方程式2Na2SO3+O2=2Na2SO4.
某研究性学习小组的同学通过对亚硫酸钠组成元素的价态进行分析后认为Na2SO3溶液在存放过程中有可能变质,若已变质,则相应反应的化学方程式2Na2SO3+O2=2Na2SO4.