12.下列各组稀溶液,不用其他试剂或试纸,仅利用溶液间的相互反应,不能将它们鉴别开来的是( )
| A. | 硫酸、硫酸镁、碳酸钠、氢氧化钠 | B. | 硝酸钾、碳酸钠、氯化钙、氯化钡 | ||
| C. | 盐酸、硫酸钠、偏铝酸钠、氢氧化钾 | D. | 硫酸、硫酸铝、氯化钠、氢氧化钠 |
11.设NA 为阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 25℃时,pH=1的醋酸溶液中含有H+的数目为0.1NA | |
| B. | 100mL 18.4mol•L-1 的浓硫酸与足量的铜加热反应后,生成SO2 分子数为0.92NA | |
| C. | 将CO2 通过Na2O2 ,当固体质量增加a g时,反应中转移的电子数为a$\frac{{N}_{A}}{28}$ | |
| D. | 标准状况下,11.2L正丁烷所含公用电子对数为7NA |
10.某同学利用锌、氧化铜和稀硫酸制取铜,他设计了两套方案,
方案Ⅰ:利用锌与足量稀硫酸反应制氢气,氢气还原氧化铜;
方案Ⅱ:氧化铜溶于稀硫酸生成硫酸铜,然后用锌与硫酸铜反应制备铜.
下列关于方案Ⅰ和Ⅱ的评价不正确的是( )
方案Ⅰ:利用锌与足量稀硫酸反应制氢气,氢气还原氧化铜;
方案Ⅱ:氧化铜溶于稀硫酸生成硫酸铜,然后用锌与硫酸铜反应制备铜.
下列关于方案Ⅰ和Ⅱ的评价不正确的是( )
| A. | 方案Ⅱ比方案Ⅰ操作简便 | |
| B. | 等质量的锌,相同条件下方案Ⅰ和方案Ⅱ中制得的铜的质量相同 | |
| C. | 等质量的H2SO4参加反应,方案Ⅰ制取铜的质量比方案Ⅱ的少 | |
| D. | 为了加快锌与稀硫酸反应,可以在溶液中加入少量氧化铜 |
9.A、B、C、D、E是原子序数依次增大的短周期主族元素.A是电子数等于电子层数的非金属,B是地壳中含量最多的元素,C的族序数比A的族序数大1,D的次外层电子数等于最内层电子数和最外层电子数之和.下列叙述中正确的是( )
| A. | 元素的离子半径A<B<C<E | |
| B. | 工业上利用电解C的氯化物溶液的方法制备单质C | |
| C. | D的气态氢化物和最高价氧化物的水化物可能发生氧化还原反应 | |
| D. | D与C,A与D形成的化合物中化学键类型相同 |
5.海洋是巨大的资源宝库,具有非常广阔的开发前景.
Ⅰ.从海水中提取食盐和溴的过程如下:
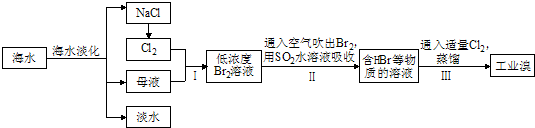
(1)请列举海水淡化的三种方法:蒸馏法、电渗析法、离子交换法.
(2)用于电解的食盐水需先除去其中的Ca2+、Mg2+、SO42-等杂质.某次除杂操作时,往粗盐水中先加入过量的BaCl2(填化学式),至沉淀不再产生后,继续加入过量的Na2CO3和NaOH,充分反应后将沉淀一并滤去.经检测发现滤液中仍含有一定量的SO42-,已知Ksp(BaSO4)=1.1×10-10、Ksp(BaCO3)=5.1×10-9,请分析滤液中仍含有SO42-的原因是:BaSO4和BaCO3的Ksp相差不大,当溶液中存在大量CO32-时,BaSO4(s)会部分转化为BaCO3(s).将提纯后的NaCl溶液进行电解,在电解槽中可直接得到的产品有H2、Cl2、NaOH或H2、NaClO.
(3)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,其目的为富集溴元素.
(4)步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,有关反应的离子方程式为:
Br2+SO2+2H2O═4H++SO42-+2Br-,由此反应可知,除环境保护外,在工业生产中应解决的主要问题是强酸对设备的严重腐蚀.
Ⅱ.按以下实验方案可从海洋动物炳海鞘中提取具有抗肿瘤活性的天然产物.
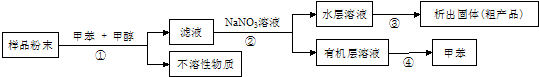
(5)下列叙述正确的是a、b、d(填序号).
a.步骤①需要过滤装置 b.步骤②需要用到分液漏斗
c.步骤③需要用到坩埚 d.步骤④需要蒸馏装置
Ⅲ.海水淡化后剩余的浓海水经过一系列工艺流程可以获取其他产品,如Mg(OH)2等.浓海水的主要成分如下:
(6)理论上,1L浓海水最多可得到Mg(OH)2的质量为69.6 g.
0 168534 168542 168548 168552 168558 168560 168564 168570 168572 168578 168584 168588 168590 168594 168600 168602 168608 168612 168614 168618 168620 168624 168626 168628 168629 168630 168632 168633 168634 168636 168638 168642 168644 168648 168650 168654 168660 168662 168668 168672 168674 168678 168684 168690 168692 168698 168702 168704 168710 168714 168720 168728 203614
Ⅰ.从海水中提取食盐和溴的过程如下:

(1)请列举海水淡化的三种方法:蒸馏法、电渗析法、离子交换法.
(2)用于电解的食盐水需先除去其中的Ca2+、Mg2+、SO42-等杂质.某次除杂操作时,往粗盐水中先加入过量的BaCl2(填化学式),至沉淀不再产生后,继续加入过量的Na2CO3和NaOH,充分反应后将沉淀一并滤去.经检测发现滤液中仍含有一定量的SO42-,已知Ksp(BaSO4)=1.1×10-10、Ksp(BaCO3)=5.1×10-9,请分析滤液中仍含有SO42-的原因是:BaSO4和BaCO3的Ksp相差不大,当溶液中存在大量CO32-时,BaSO4(s)会部分转化为BaCO3(s).将提纯后的NaCl溶液进行电解,在电解槽中可直接得到的产品有H2、Cl2、NaOH或H2、NaClO.
(3)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,其目的为富集溴元素.
(4)步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,有关反应的离子方程式为:
Br2+SO2+2H2O═4H++SO42-+2Br-,由此反应可知,除环境保护外,在工业生产中应解决的主要问题是强酸对设备的严重腐蚀.
Ⅱ.按以下实验方案可从海洋动物炳海鞘中提取具有抗肿瘤活性的天然产物.

(5)下列叙述正确的是a、b、d(填序号).
a.步骤①需要过滤装置 b.步骤②需要用到分液漏斗
c.步骤③需要用到坩埚 d.步骤④需要蒸馏装置
Ⅲ.海水淡化后剩余的浓海水经过一系列工艺流程可以获取其他产品,如Mg(OH)2等.浓海水的主要成分如下:
| 离子 | Na+ | Mg2+ | Cl- | SO42- |
| 浓度/(g•L-1) | 63.7 | 28.8 | 144.6 | 46.4 |
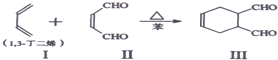
 等.①遇FeCl3溶液显紫色; ②在浓硫酸催化作用下能发生消去反应.
等.①遇FeCl3溶液显紫色; ②在浓硫酸催化作用下能发生消去反应.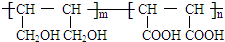 .
.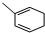 能与CH2=CHCOOH发生类似反应①的反应,生成化合物Ⅷ,写出Ⅷ的一种结构简式为
能与CH2=CHCOOH发生类似反应①的反应,生成化合物Ⅷ,写出Ⅷ的一种结构简式为 .
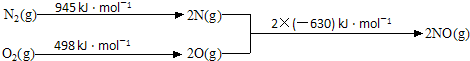
.
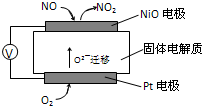
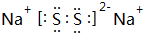 .
.