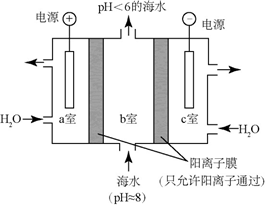
2.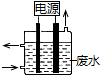 用如图所示装置除去含有CN-、Cl- 废水中的CN-时,控制溶液pH为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法不正确的是( )
用如图所示装置除去含有CN-、Cl- 废水中的CN-时,控制溶液pH为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法不正确的是( )
 用如图所示装置除去含有CN-、Cl- 废水中的CN-时,控制溶液pH为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法不正确的是( )
用如图所示装置除去含有CN-、Cl- 废水中的CN-时,控制溶液pH为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法不正确的是( )| A. | 用石墨作阳极,铁作阴极 | |
| B. | 阳极的电极反应式:Cl-+2OH--2e-═ClO-+H2O | |
| C. | 阴极的电极反应式:2H2O+2e-═H2↑+2OH- | |
| D. | 除去CN-的反应:2CN-+5ClO-+2H+═N2↑+2CO2↑+5Cl-+H2O |
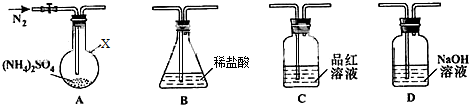
1.下列操作或装置能达到实验目的是( )
| A. | 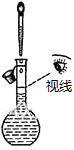 配置一定浓度的NaCl溶液 | B. | 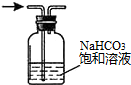 除去氯气中的HCl气体 | ||
| C. | 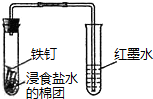 观察铁的吸氧腐蚀 | D. | 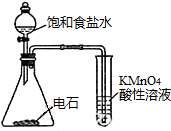 检验乙炔的还原性 检验乙炔的还原性 |
20.下列有关CuSO4溶液的叙述正确的是( )
| A. | 该溶液中Na+、NH4+、NO3-、Mg2+可以大量共存 | |
| B. | 通入CO2气体产生蓝色沉淀 | |
| C. | 与H2S反应的离子方程式:Cu2++S2-=CuS↓ | |
| D. | 与过量浓氨水反应的离子方程式:Cu2++2NH3•H2O=Cu(OH)2↓+2NH4+ |
19.下列物质在生话中应用时,起还原作用的是( )
0 168502 168510 168516 168520 168526 168528 168532 168538 168540 168546 168552 168556 168558 168562 168568 168570 168576 168580 168582 168586 168588 168592 168594 168596 168597 168598 168600 168601 168602 168604 168606 168610 168612 168616 168618 168622 168628 168630 168636 168640 168642 168646 168652 168658 168660 168666 168670 168672 168678 168682 168688 168696 203614
| A. | 明矾作净水剂 | B. | 甘油作护肤保湿剂 | ||
| C. | 漂粉精作消毒剂 | D. | 铁粉作食品袋内的脱氧剂 |
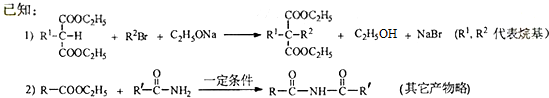
 $→_{△①}^{NaOH水溶液}$$\stackrel{A}{({C}_{5}{H}_{12}{O}_{2)}}$$→_{②}^{氧化}$$\underset{B}{({C}_{5}{H}_{8}{O}_{2})}$$→_{③}^{氧化}$C$→_{浓硫酸△④}^{试剂Ⅰ(C_{2}H_{5}OH)}$D
$→_{△①}^{NaOH水溶液}$$\stackrel{A}{({C}_{5}{H}_{12}{O}_{2)}}$$→_{②}^{氧化}$$\underset{B}{({C}_{5}{H}_{8}{O}_{2})}$$→_{③}^{氧化}$C$→_{浓硫酸△④}^{试剂Ⅰ(C_{2}H_{5}OH)}$D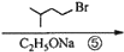
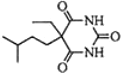
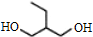 +2NaBr.
+2NaBr.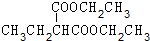 +(CH3)2CHCH2CH2Br+CH3CH2ONa→
+(CH3)2CHCH2CH2Br+CH3CH2ONa→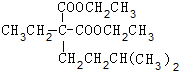 +CH3CH2OH+NaBr.
+CH3CH2OH+NaBr.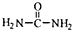 .
.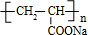 .
.