题目内容
2.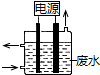 用如图所示装置除去含有CN-、Cl- 废水中的CN-时,控制溶液pH为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法不正确的是( )
用如图所示装置除去含有CN-、Cl- 废水中的CN-时,控制溶液pH为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法不正确的是( )| A. | 用石墨作阳极,铁作阴极 | |
| B. | 阳极的电极反应式:Cl-+2OH--2e-═ClO-+H2O | |
| C. | 阴极的电极反应式:2H2O+2e-═H2↑+2OH- | |
| D. | 除去CN-的反应:2CN-+5ClO-+2H+═N2↑+2CO2↑+5Cl-+H2O |
分析 A.该电解质溶液呈碱性,电解时,用不活泼金属或导电非金属作负极,可以用较不活泼金属作正极;
B.阳极上氯离子失电子生成氯气,氯气和氢氧根离子反应生成次氯酸根离子和水;
C.阴极上水失电子生成氢气和氢氧根离子;
D.阳极产生的ClO-将CN-氧化为两种无污染的气体,该反应在碱性条件下进行,所以应该有氢氧根离子生成.
解答 解:A.该电解质溶液呈碱性,电解时,用不活泼金属或导电非金属作负极,可以用较不活泼金属作正极,所以可以用石墨作氧化剂、铁作阴极,故A正确;
B.阳极上氯离子失电子生成氯气,氯气和氢氧根离子反应生成次氯酸根离子和水,所以阳极反应式为Cl-+2OH--2e-═ClO-+H2O,故B正确;
C.电解质溶液呈碱性,则阴极上水失电子生成氢气和氢氧根离子,电极反应式为2H2O+2e-═H2↑+2OH-,故C正确;
D.阳极产生的ClO-将CN-氧化为两种无污染的气体,两种气体为二氧化碳和氮气,该反应在碱性条件下进行,所以应该有氢氧根离子生成,反应方程式为2CN-+5ClO-+H2O═N2↑+2CO2↑+5Cl-+2OH-,故D错误;
故选D.
点评 本题为2015年四川省高考化学试题,涉及电解原理,明确各个电极上发生的反应及电解原理是解本题关键,易错选项是BD,注意B中反应生成物,注意D中碱性条件下不能有氢离子参加反应或生成.

练习册系列答案
相关题目
12.将1.800g FeC2O4•2H2O固体放在一个可称量的容器中加热,分解产物为CO、CO2、H2O与铁的氧化物,已知500℃时残留固体质量为0.800g,则此时所得气体的平均摩尔质量为( )
| A. | 25g/mol | B. | 27g/mol | C. | 30g/mol | D. | 32g/mol |
10.下列关于自然界中氮循环(如图)的说法不正确的是( )
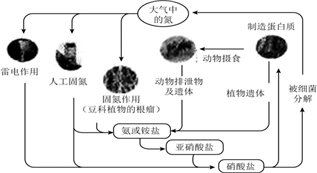

| A. | 氮元素均被氧化 | |
| B. | 工业合成氨属于人工固氮 | |
| C. | 含氮无机物和含氮有机物可相互转化 | |
| D. | 碳、氢、氧三种元素也参加了氮循环 |
7.下列说法正确的是( )
| A. | I的原子半径大于Br,HI比HBr的热稳定性强 | |
| B. | P的非金属性强于Si,H3PO4比H2SiO3的酸性强 | |
| C. | Al2O3和MgO均可与NaOH溶液反应 | |
| D. | SO2和SO3混合气体通入Ba(NO3)2溶液可得到BaSO3和BaSO4 |
9.在常温下,对于pH=3的醋酸溶液.下列说法正确的是( )
| A. | 在醋酸溶液中,NH4+、Na+、SiO32-、C2O42-能大量共存 | |
| B. | 与Na2S2O3溶液反应的离子方程式:S2O32-+2H+═S↓+SO2↑+H2O | |
| C. | 常温下,加水稀释醋酸,$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)•c(O{H}^{-})}$增大 | |
| D. | 该醋酸溶液中c(CH3COO-)<0.001 mol•L-1 |
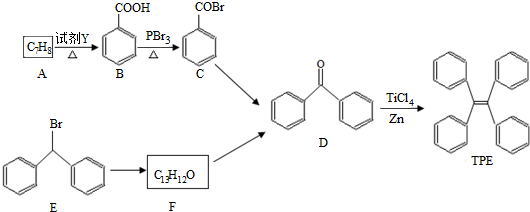
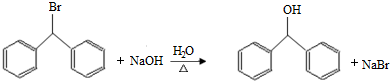 ;
; )的一元取代物;②存在羟甲基(-CH2OH),写出W所有可能的结构简式:
)的一元取代物;②存在羟甲基(-CH2OH),写出W所有可能的结构简式: ;
;




 .
.