题目内容
20.下列有关CuSO4溶液的叙述正确的是( )| A. | 该溶液中Na+、NH4+、NO3-、Mg2+可以大量共存 | |
| B. | 通入CO2气体产生蓝色沉淀 | |
| C. | 与H2S反应的离子方程式:Cu2++S2-=CuS↓ | |
| D. | 与过量浓氨水反应的离子方程式:Cu2++2NH3•H2O=Cu(OH)2↓+2NH4+ |
分析 A.该组离子之间不反应,与硫酸铜也不反应;
B.通入CO2气体,与硫酸铜溶液不反应;
C.H2S在离子反应中保留化学式;
D.与过量浓氨水反应,生成络离子.
解答 解:A.该组离子之间不反应,与硫酸铜也不反应,则可大量共存,故A正确;
B.通入CO2气体,与硫酸铜溶液不反应,不能生成蓝色沉淀,故B错误;
C.H2S在离子反应中保留化学式,则与H2S反应的离子方程式为Cu2++H2S=CuS↓+2H+,故C错误;
D.与过量浓氨水反应,生成络离子,则离子反应为Cu2++4NH3•H2O=[Cu(NH3)4]2++4H2O,故D错误;
故选A.
点评 本题考查离子共存及离子反应,为高频考点,为2015年高考真题,把握常见离子之间的反应为解答的关键,侧重复分解反应及络合反应的离子反应考查,题目难度不大.

练习册系列答案
 快乐5加2金卷系列答案
快乐5加2金卷系列答案
相关题目
10.下列实验能获得成功的是( )
| A. | 苯与浓溴水用铁作催化剂制溴苯 | B. | 将苯与浓硝酸混合加热制硝基苯 | ||
| C. | 加入水后分液可除去溴苯中的溴 | D. | 可用分液漏斗分离硝基苯和水 |
11.某同学将光亮的镁条放入盛有NH4Cl溶液的试管中,有大量气泡产生,为探究该反应原理,该同学做了以下实验并观察到相关现象,由此得出的结论不合理的是( )
| 选项 | 实验及现象 | 结论 |
| A | 将湿润的红色石蕊试纸放在试管口,试纸变蓝 | 反应中有NH3产生 |
| B | 收集产生的气体并点燃,火焰呈淡蓝色 | 反应中有H2产生 |
| C | 收集气体的同时测得溶液的pH为8.6 | 弱碱性溶液中Mg也可被氧化 |
| D | 将光亮的镁条放入pH为8.6的NaHCO3溶液中,有气泡产生 | 弱碱性溶液中OH-氧化了Mg |
| A. | A | B. | B | C. | C | D. | D |
12.羰基硫(COS)可作为一种粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害.在恒容密闭容器中,将CO和H2S混合加热并达到下列平衡:
CO(g)+H2S(g)?COS(g)+H2(g) K=0.1
反应前CO的物质的量为10mol,平衡后CO物质的量为8mol,下列说法正确的是( )
CO(g)+H2S(g)?COS(g)+H2(g) K=0.1
反应前CO的物质的量为10mol,平衡后CO物质的量为8mol,下列说法正确的是( )
| A. | 升高温度,H2S浓度增加,表明该反应是吸热反应 | |
| B. | 通入CO后,正反应速率逐渐增大 | |
| C. | 反应前H2S物质的量为7mol | |
| D. | CO的平衡转化率为80% |
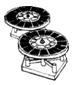
9.某同学采用硫铁矿焙烧取硫后的烧渣(主要成分为Fe2O3、SiO2、Al2O3,不考虑其他杂质) 制取七水合硫酸亚铁(FeSO4•7H2O),设计了如下流程:
下列说法不正确的是( )

下列说法不正确的是( )
| A. | 溶解烧渣选用足量硫酸,试剂X选用铁粉 | |
| B. | 固体1中一定含有SiO2,控制pH是为了使Al3+转化为Al(OH)3,进入固体2 | |
| C. | 从溶液2得到FeSO4•7H2O产品的过程中,须控制条件防止其氧化和分解 | |
| D. | 若改变方案,在溶液1中直接加NaOH至过量,得到的沉淀用硫酸溶解,其溶液经结晶分离也可得到FeSO4•7H2O |
7.现有物质的量浓度均为0.1mol•L-1的四种溶液各25mL:①氨水 ②NH4Cl溶液 ③Na2CO3溶液 ④NaHCO3溶液,下列说法正确的是( )
| A. | 4种溶液pH的大小顺序:①>④>③>② | |
| B. | ①、②混合后pH>7,则混合溶液中c(NH4+)<c(NH3•H2O) | |
| C. | ①、②中分别加入25 mL 0.1 mol•L-1盐酸后,溶液中c(NH4+):①>② | |
| D. | ③、④中分别加入12.5 mL 0.1mol•L-1 NaOH溶液后,两溶液中离子种类相同 |



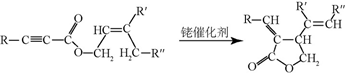
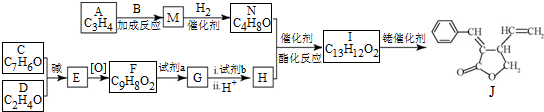

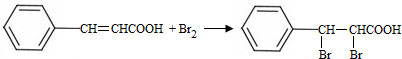 ;试剂b是NaOH、醇溶液.
;试剂b是NaOH、醇溶液.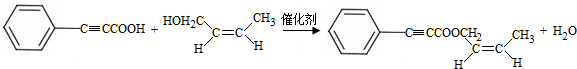 .
. $→_{△①}^{NaOH水溶液}$$\stackrel{A}{({C}_{5}{H}_{12}{O}_{2)}}$$→_{②}^{氧化}$$\underset{B}{({C}_{5}{H}_{8}{O}_{2})}$$→_{③}^{氧化}$C$→_{浓硫酸△④}^{试剂Ⅰ(C_{2}H_{5}OH)}$D
$→_{△①}^{NaOH水溶液}$$\stackrel{A}{({C}_{5}{H}_{12}{O}_{2)}}$$→_{②}^{氧化}$$\underset{B}{({C}_{5}{H}_{8}{O}_{2})}$$→_{③}^{氧化}$C$→_{浓硫酸△④}^{试剂Ⅰ(C_{2}H_{5}OH)}$D


 +2NaBr.
+2NaBr.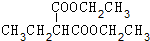 +(CH3)2CHCH2CH2Br+CH3CH2ONa→
+(CH3)2CHCH2CH2Br+CH3CH2ONa→ +CH3CH2OH+NaBr.
+CH3CH2OH+NaBr. .
. .
.