7.X、Y、Z三种短周期元素,其单质在常温下均为无色气体,它们的原子序数之和为16.在适当条件下三种单质两两化合,可发生如图1所示变化.己知l个B分子中含有Z元素的原子个数比C分子中含有Z元素的原子个数少1个.请回答下列问题:
(1)由 X、Y、Z三种元素共同组成的三种不同种类的常见化合物的化学式为NH4NO3、NH3•H2O、HNO3,相同浓度上述水溶液中由水电离出的c(H+)最小的是HNO3(填写化学式).
(2)Allis-Chalmers制造公司发现可以用C作为燃料电池的燃料,以氢氧化钾溶液为介质,反应生成对环境无污染的常见物质,试写出该电池负极的电极反应式4NH3+12OH--12e-=2N2+12H2O,溶液中OH-向负极移动(填“正”或“负”).
(3)Z分别与X、Y两元素可以构成18个电子分子甲和乙,其分子中只存在共价单键,常温下甲、乙均为无色液体,甲随着温度升高分解速率加快.
①乙能够将CuO还原为Cu2O,已知每lmol乙参加反应有4mole-转移,该反应的化学方程式为N2H4+4CuO=N2↑+2Cu2O+2H2O.
②将铜粉末用10%甲和3.0mol•L-1H2SO4混合溶液处埋,测得不同温度下铜的平均溶解速率如下表:
由表中数据可知,当温度高于40℃时,铜的平均溶解速率随着温度的升高而下降,其主要原因是温度升高H2O2的分解速率加快,导致H2O2的浓度降低从而使铜的溶解速率慢.
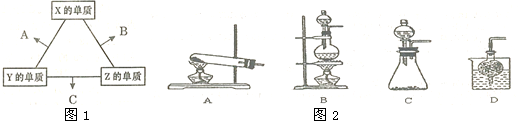
③实验室可用甲作试剂取X的单质,发生装置可选用图2中的C(填装置代号).

(1)由 X、Y、Z三种元素共同组成的三种不同种类的常见化合物的化学式为NH4NO3、NH3•H2O、HNO3,相同浓度上述水溶液中由水电离出的c(H+)最小的是HNO3(填写化学式).
(2)Allis-Chalmers制造公司发现可以用C作为燃料电池的燃料,以氢氧化钾溶液为介质,反应生成对环境无污染的常见物质,试写出该电池负极的电极反应式4NH3+12OH--12e-=2N2+12H2O,溶液中OH-向负极移动(填“正”或“负”).
(3)Z分别与X、Y两元素可以构成18个电子分子甲和乙,其分子中只存在共价单键,常温下甲、乙均为无色液体,甲随着温度升高分解速率加快.
①乙能够将CuO还原为Cu2O,已知每lmol乙参加反应有4mole-转移,该反应的化学方程式为N2H4+4CuO=N2↑+2Cu2O+2H2O.
②将铜粉末用10%甲和3.0mol•L-1H2SO4混合溶液处埋,测得不同温度下铜的平均溶解速率如下表:
| 温度(℃) | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
| 铜的平均溶解速率 (×10-3mol•L-1•min-1) | 7.34 | 8.01 | 9.25 | 7.98 | 7.24 | 6.73 | 5.76 |
③实验室可用甲作试剂取X的单质,发生装置可选用图2中的C(填装置代号).
6.X、Y是周期表前二十号元素,已知X、Y之间原子序数相差3,X、Y能形成化合物M.下列说法正确的是( )
| A. | 若X、Y处于同一周期,则化合物M不可能是正四面体型分子 | |
| B. | 若X的单质常温下是气体,则Y的单质常温下也是气体 | |
| C. | 若X、Y两元素周期数差1,则属于离子化合物的M只有四种 | |
| D. | 若M属于离子化合物,则其中可能含有非极性键 |
5.a、b、c、d是原子序数依次递增的四种元素,a、b、c三种元素的原子核外电子数之和与Cl-的核外电子数相等,a、c分别得到一个电子后均形成稀有气体原子的稳定电子层结构,d是生活中用量最大的金属,其简单离子有两种常见价态,下列说法正确的是( )
| A. | 离子半径:c>b>a | |
| B. | a与c形成化合物的溶液有毒,要密封保存于玻璃瓶中 | |
| C. | a2b2与d的一种较高价态离子的盐溶液混合时会产生大量的b2 | |
| D. | d高价离子在溶液中与c的低价离子因发生氧化还原反应而不能大量共存 |
4.短周期主族元素X、Y、Z、W、Q的原子序数依次增大.X的气态氢化物极易溶于Y的氢化物中,常温下,Z的块状单质能溶于W的最高价氧化物的水化物的稀溶液,却不溶于其浓溶液.下列说法正确的是( )
| A. | 元素Y的最高正化合价为+6 | |
| B. | 离子半径的大小顺序为W>Q>Z>X>Y | |
| C. | 气态氢化物的沸点:Y>W | |
| D. | 元素W的最高价氧化物对应的水化物酸性比Q的强 |
3.下列反应所得溶液中,一定只含一种溶质的是( )
| A. | 向铁粉中加入稀硝酸 | |
| B. | 向烧碱溶液中通入CO2气体 | |
| C. | 向稀盐酸中滴入少量的NaAlO2溶液 | |
| D. | 向MgSO4、H2SO4的混合溶液中加入过量的Ba(OH)2溶液 |
2.海水中含有MgCl2,从海水中提取镁,正确的方法是( )
| A. | 海水$\stackrel{NaOH}{→}$Mg(OH)2$\stackrel{电解}{→}$Mg | |
| B. | 海水$\stackrel{HCl}{→}$MgCl2溶液→MgCl2(熔融)$\stackrel{电解}{→}$Mg | |
| C. | 海水$\stackrel{石灰乳}{→}$Mg(OH)2$\stackrel{灼烧}{→}$MgO$\stackrel{电解}{→}$Mg | |
| D. | 海水$\stackrel{石灰乳}{→}$ Mg(OH)2$\stackrel{BCl}{→}$ MgCl2溶液→MgCl2(熔融)$\stackrel{电解}{→}$Mg |
1.下列解释事实的方程式不准确的是( )
| A. | 铝热法炼铁:Fe2O3+2Al$\frac{\underline{\;\;△\;\;}}{\;}$Al2O3+2Fe | |
| B. | 工业上用NH3制备NO:4NH3+5O2$\frac{\underline{\;\;△\;\;}}{\;}$4NO+6H2O | |
| C. | 向受酸雨影响的湖泊中喷洒CaCO3粉末:CO32-+2H+$\frac{\underline{\;催化剂\;}}{\;}$H2O+CO2↑ | |
| D. | 过氧化钠用于呼吸面具中作为氧气的2Na2O2+2CO2═2Na2CO3+O2 |
20.某溶液中有NH4+、Ca2+、Mg2+和Al3+四种离子,若向其中加入过量的氢氧化钠溶液,微热并搅拌,再加入过量盐酸,溶液中浓度变化最大的离子是( )
| A. | NH4+ | B. | Ca2+ | C. | Mg2+ | D. | Al3+ |
19.一种新型净水剂PAFC{聚合氯化铁铝,[AlFe(OH)nCl6-n]m,n<5,m<10},广泛用于生活用水的净化和废水的净化,有关PAFC的说法正确的是( )
| A. | PAFC用于净化饮用水时,可以除去水中所有的有害物质 | |
| B. | PAFC中铁显+2价 | |
| C. | PAFC可溶于盐酸溶液 | |
| D. | PAFC没有氧化性 |
18.下列有关元素化合物的叙述中正确的是( )
0 168438 168446 168452 168456 168462 168464 168468 168474 168476 168482 168488 168492 168494 168498 168504 168506 168512 168516 168518 168522 168524 168528 168530 168532 168533 168534 168536 168537 168538 168540 168542 168546 168548 168552 168554 168558 168564 168566 168572 168576 168578 168582 168588 168594 168596 168602 168606 168608 168614 168618 168624 168632 203614
| A. | 钠在空气中燃烧生成白色的氧化钠固体 | |
| B. | 检验FeCl2溶液中的少量Fe3+,可以用KSCN溶液 | |
| C. | 二氧化硫的水溶液能使紫色石蕊溶液变红,随后使之褪色 | |
| D. | 普通玻璃的组成可用Na2O•CaO•6SiO2表示,是纯净物 |