题目内容
6.X、Y是周期表前二十号元素,已知X、Y之间原子序数相差3,X、Y能形成化合物M.下列说法正确的是( )| A. | 若X、Y处于同一周期,则化合物M不可能是正四面体型分子 | |
| B. | 若X的单质常温下是气体,则Y的单质常温下也是气体 | |
| C. | 若X、Y两元素周期数差1,则属于离子化合物的M只有四种 | |
| D. | 若M属于离子化合物,则其中可能含有非极性键 |
分析 A.Si与Cl或C与F形成的化合物为正四面体;
B.前20号元素中X、Y能形成化合物M,应为主族元素,结合常温下单质为气体的物质进行解答;
C.若X、Y两元素周期数差1,则属于离子化合物的M有Na2O、Na2O2、MgF2、K2S、CaCl2等;
D.如果M为过氧化钠,过氧化钠中含有离子键和非极性键.
解答 解:A.若X、Y处于同一周期,原子序数相差3,Si与Cl或C与F形成的化合物为正四面体,故A错误;
B.前20号元素中X、Y能形成化合物M,应为主族元素,单质为气体的有氢气、氮气、氧气、氟气、氯气,不存在原子序数相差3的两种元素,故X的单质常温下是气体,则Y的单质常温下不可能是气体,故B错误;
C.为Na与O时,可以形成Na2O、Na2O2,为Mg与F时可以形成MgF2,为K与S时可以形成K2S,为Ca与Cl时可以形成CaCl2等,属于离子化合物M超过4种,故C错误;
D.为Na与O时,可以形成Na2O2,属于离子晶体,其中氧原子之间形成非极性键,故D正确;
故选D.
点评 本题考查位置结构性质关系应用,题目难度中等,注意利用列举法进行解答,需要学生对基础知识全面掌握,注意特殊物质结构.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
16.将分别盛有熔融NaCl、MgCl2、Al2O3(熔有冰晶石)的三个电解槽,在一定条件下通电一段时间后,析出Na、Mg、Al的物质的量之比是( )
| A. | 1:2:3 | B. | 3:2:1 | C. | 6:3:1 | D. | 6:3:2 |
17.已知:将Cl2通入适量KOH溶液,产物中可能有KCl、KClO、KClO3,且$\frac{c(C{l}^{-})}{c(Cl{O}^{-})}$的值与温度高低有关.当n(KOH)=a mol时,下列有关说法错误的是( )
| A. | 若某温度下,反应后$\frac{c(C{l}^{-})}{c(Cl{O}^{-})}$=11,则溶液中$\frac{c(Cl{O}^{-})}{c(Cl{{O}_{3}}^{-})}$=$\frac{1}{2}$ | |
| B. | 参加反应的氯气的物质的量等于$\frac{1}{2}$a mol | |
| C. | 改变温度,产物中KClO的最大理论产量为$\frac{1}{2}$a mol | |
| D. | 改变温度,产物中KClO3的最大理论产量为$\frac{1}{7}$a mol |
1.下列解释事实的方程式不准确的是( )
| A. | 铝热法炼铁:Fe2O3+2Al$\frac{\underline{\;\;△\;\;}}{\;}$Al2O3+2Fe | |
| B. | 工业上用NH3制备NO:4NH3+5O2$\frac{\underline{\;\;△\;\;}}{\;}$4NO+6H2O | |
| C. | 向受酸雨影响的湖泊中喷洒CaCO3粉末:CO32-+2H+$\frac{\underline{\;催化剂\;}}{\;}$H2O+CO2↑ | |
| D. | 过氧化钠用于呼吸面具中作为氧气的2Na2O2+2CO2═2Na2CO3+O2 |
11.下列有关周期表的说法中,正确的是( )
| A. | 每个主族都含有非金属元素 | B. | 构成半导体的元素都是非金属元素 | ||
| C. | 过渡元素都属于金属元素 | D. | 非金属元素都位于短周期 |
18. 某氢氧燃料电池的原理如图所示.该电池的负极反应式为:H2-2e-═2H+.则下列判断中错误的是( )
某氢氧燃料电池的原理如图所示.该电池的负极反应式为:H2-2e-═2H+.则下列判断中错误的是( )
 某氢氧燃料电池的原理如图所示.该电池的负极反应式为:H2-2e-═2H+.则下列判断中错误的是( )
某氢氧燃料电池的原理如图所示.该电池的负极反应式为:H2-2e-═2H+.则下列判断中错误的是( )| A. | a处通入的是H2 | B. | 电解质溶液可能是NaOH溶液 | ||
| C. | 电极X是负极,被氧化 | D. | Y极的反应为O2+4e-+4H+═2H2O |

 ;
; 研究性学习是培养学生创造思维的良好方法,某研究性学习小组将下列装置如图连接,C、D、E、F都是惰性电极.将电源接通后,向乙中滴入酚酞试液,在F极附近显红色.
研究性学习是培养学生创造思维的良好方法,某研究性学习小组将下列装置如图连接,C、D、E、F都是惰性电极.将电源接通后,向乙中滴入酚酞试液,在F极附近显红色.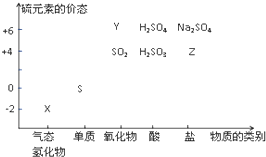 物质的类别和核心元素的化合价是研究物质性质的两个重要视角.硫及其化合物与价态变化为坐标的二维转化关系如图所示
物质的类别和核心元素的化合价是研究物质性质的两个重要视角.硫及其化合物与价态变化为坐标的二维转化关系如图所示 ;其水溶液在空气中放置易变浑浊,写出反应的化学方程式2H2S+O2=2S↓+2H2O;
;其水溶液在空气中放置易变浑浊,写出反应的化学方程式2H2S+O2=2S↓+2H2O;