题目内容
2.海水中含有MgCl2,从海水中提取镁,正确的方法是( )| A. | 海水$\stackrel{NaOH}{→}$Mg(OH)2$\stackrel{电解}{→}$Mg | |
| B. | 海水$\stackrel{HCl}{→}$MgCl2溶液→MgCl2(熔融)$\stackrel{电解}{→}$Mg | |
| C. | 海水$\stackrel{石灰乳}{→}$Mg(OH)2$\stackrel{灼烧}{→}$MgO$\stackrel{电解}{→}$Mg | |
| D. | 海水$\stackrel{石灰乳}{→}$ Mg(OH)2$\stackrel{BCl}{→}$ MgCl2溶液→MgCl2(熔融)$\stackrel{电解}{→}$Mg |
分析 海水中含有Mg 2+,Mg 2+和OH-反应生成沉淀Mg(OH)2,Mg(OH)2和HCl反应生成可溶性的MgCl2,蒸发浓缩、冷却结晶得到MgCl2•6H2O,在HCl氛围中加热MgCl2•6H2O生成MgCl2,最后采用电解熔融MgCl2方法冶炼Mg,据此分析解答.
解答 解:A.在海水苦卤中加氢氧化钠过滤得沉淀氢氧化镁,Mg(OH)2热稳定性差,受热分解生成MgCl2,工业上,电解熔融MgCl2冶炼金属镁,故A错误;
B.海水中含有可溶性的Mg2+、Ca2+、Fe3+、SO42-、Na+、Cl-、加盐酸得不到纯净的氯化镁溶液,所以无法得到纯净的氯化镁固体,故B错误;
C.在海水苦卤中加氢氧化钙过滤得沉淀氢氧化镁,灼烧得到氧化镁,但MgO的熔点为2800℃、熔点高,电解时耗能高,所以,工业上,电解熔融MgCl2冶炼金属镁,故C错误;
D.在海水苦卤中加氢氧化钙,海水中含有Mg 2+,Mg 2+和OH-反应生成沉淀Mg(OH)2,过滤得沉淀氢氧化镁,再将沉淀分离后加入盐酸Mg(OH)2+2HCl=MgCl2+2H2O,变成MgCl2,蒸发浓缩、冷却结晶得到MgCl2•6H2O,在HCl氛围中加热MgCl2•6H2O生成MgCl2,Mg属于活泼金属,采用电解熔融MgCl2的方法冶炼Mg,故D正确;
故选D.
点评 本题考查了海水资源的利用,主要考查了工业制镁的步骤,熟记相关知识是解答的关键,属基础性知识考查题,题目难度不大.

练习册系列答案
 53随堂测系列答案
53随堂测系列答案
相关题目
12.以惰性电极电解 CuSO4 溶液.若阳极上产生气体的物质的量为0.01mol,则阴极上析出Cu的质量为.( )
| A. | 0.64g | B. | 1.28g | C. | 2.56g | D. | 5.12g |
13.向等物质的量浓度的NaOH和Na2CO3的混合液中加入稀盐酸.下列离子方程式与事实不相符的是( )
| A. | OH-+CO32-+2H+→HCO3-+H2O | B. | 2OH-+CO32-+3H+→HCO3-+2H2O | ||
| C. | 2OH-+CO32-+4H+→CO2↑+2H2O | D. | OH-+CO32-+3H+→CO2↑+2H2O |
7.X、Y、Z三种短周期元素,其单质在常温下均为无色气体,它们的原子序数之和为16.在适当条件下三种单质两两化合,可发生如图1所示变化.己知l个B分子中含有Z元素的原子个数比C分子中含有Z元素的原子个数少1个.请回答下列问题:
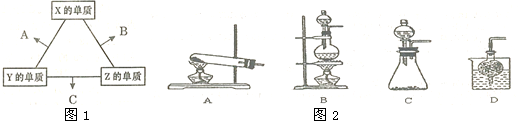
(1)由 X、Y、Z三种元素共同组成的三种不同种类的常见化合物的化学式为NH4NO3、NH3•H2O、HNO3,相同浓度上述水溶液中由水电离出的c(H+)最小的是HNO3(填写化学式).
(2)Allis-Chalmers制造公司发现可以用C作为燃料电池的燃料,以氢氧化钾溶液为介质,反应生成对环境无污染的常见物质,试写出该电池负极的电极反应式4NH3+12OH--12e-=2N2+12H2O,溶液中OH-向负极移动(填“正”或“负”).
(3)Z分别与X、Y两元素可以构成18个电子分子甲和乙,其分子中只存在共价单键,常温下甲、乙均为无色液体,甲随着温度升高分解速率加快.
①乙能够将CuO还原为Cu2O,已知每lmol乙参加反应有4mole-转移,该反应的化学方程式为N2H4+4CuO=N2↑+2Cu2O+2H2O.
②将铜粉末用10%甲和3.0mol•L-1H2SO4混合溶液处埋,测得不同温度下铜的平均溶解速率如下表:
由表中数据可知,当温度高于40℃时,铜的平均溶解速率随着温度的升高而下降,其主要原因是温度升高H2O2的分解速率加快,导致H2O2的浓度降低从而使铜的溶解速率慢.
③实验室可用甲作试剂取X的单质,发生装置可选用图2中的C(填装置代号).

(1)由 X、Y、Z三种元素共同组成的三种不同种类的常见化合物的化学式为NH4NO3、NH3•H2O、HNO3,相同浓度上述水溶液中由水电离出的c(H+)最小的是HNO3(填写化学式).
(2)Allis-Chalmers制造公司发现可以用C作为燃料电池的燃料,以氢氧化钾溶液为介质,反应生成对环境无污染的常见物质,试写出该电池负极的电极反应式4NH3+12OH--12e-=2N2+12H2O,溶液中OH-向负极移动(填“正”或“负”).
(3)Z分别与X、Y两元素可以构成18个电子分子甲和乙,其分子中只存在共价单键,常温下甲、乙均为无色液体,甲随着温度升高分解速率加快.
①乙能够将CuO还原为Cu2O,已知每lmol乙参加反应有4mole-转移,该反应的化学方程式为N2H4+4CuO=N2↑+2Cu2O+2H2O.
②将铜粉末用10%甲和3.0mol•L-1H2SO4混合溶液处埋,测得不同温度下铜的平均溶解速率如下表:
| 温度(℃) | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
| 铜的平均溶解速率 (×10-3mol•L-1•min-1) | 7.34 | 8.01 | 9.25 | 7.98 | 7.24 | 6.73 | 5.76 |
③实验室可用甲作试剂取X的单质,发生装置可选用图2中的C(填装置代号).
14.下列排列顺序不正确的是( )
| A. | 离子半径:Mg2+>O2->F- | B. | 原子半径:Na>S>O | ||
| C. | 热稳定性:HF>HCl>HBr | D. | 酸性:HClO4>H2SO4>H3PO4 |
11.按官能团分类,下列物质与  不同类的是( )
不同类的是( )
 不同类的是( )
不同类的是( )| A. |  | B. | 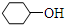 | C. | CH3CH2OH | D. | CH3OH |
12.下列说法正确的是( )
| A. | 陶瓷、玻璃和水泥都是无机非金属材料;青铜、碳素钢和石英都是合金 | |
| B. | 油脂皂化和蛋白质水解都是由高分子生成小分子的过程 | |
| C. | 已知Ksp(MnS)>Ksp(CdS) 所以工业上用MnO2制取MnCl2时,用MnS除去溶液中含有的Cd2+离子 | |
| D. | 食盐可作调味剂,也可作食品防腐剂;福尔马林可作食品的保鲜剂 |
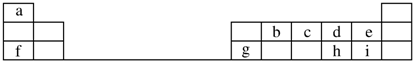
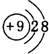 ,元素g的简单离子的结构示意图为
,元素g的简单离子的结构示意图为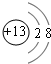 ,二者的离子半径大小顺序为F->Al3+.
,二者的离子半径大小顺序为F->Al3+.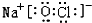 ,该化合物中所含的化学键类型为离子键、共价键.
,该化合物中所含的化学键类型为离子键、共价键.