4.X、Y、Z、Q、M为常见的短周期元素,其原子序数依次增大.有关信息如下表:
(1)X的气态氢化物的大量生产曾经解决了地球上因粮食不足而导致的饥饿和死亡问题,请写出该气态氢化物的电子式: .
.
(2)已知37Rb和53I都位于第五周期,分别与Z和M位于同一主族.下列有关说法正确的是ACD(填序号).
A.原子半径:Rb>I
B.RbM中含有共价键
C.气态氢化物热稳定性:M>I
D.Rb、Q、M的最高价氧化物对应的水化物可以两两发生反应
(3)X、Y组成的一种无色气体遇空气变为红棕色.将标准状况下40L该无色气体与15L氧气通入一定浓度的NaOH溶液中,恰好被完全吸收,同时生成两种盐.请写出该反应的离子方程式:8NO+3O2+8OH-=2NO3-+6NO2-+4H2O.
| X | 动植物生产不可缺少的元素,是蛋白质的重要成分 |
| Y | 地壳中含量居第一位 |
| Z | 短周期中其原子半径最大 |
| Q | 生活中大量使用其合金制品,工业上可用电解其氧化物的方法制备 |
| M | 海水中大量富集的元素之一,其最高正价与负价的代数和为6 |
 .
.(2)已知37Rb和53I都位于第五周期,分别与Z和M位于同一主族.下列有关说法正确的是ACD(填序号).
A.原子半径:Rb>I
B.RbM中含有共价键
C.气态氢化物热稳定性:M>I
D.Rb、Q、M的最高价氧化物对应的水化物可以两两发生反应
(3)X、Y组成的一种无色气体遇空气变为红棕色.将标准状况下40L该无色气体与15L氧气通入一定浓度的NaOH溶液中,恰好被完全吸收,同时生成两种盐.请写出该反应的离子方程式:8NO+3O2+8OH-=2NO3-+6NO2-+4H2O.
3. 现有六种元素,其中B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大.请根据下列相关信息,回答问题
现有六种元素,其中B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大.请根据下列相关信息,回答问题
(1)B基态原子中能量最高的电子,其电子云在空间有3个方向,原子轨道呈纺锤形.
(2)C和与其左右相邻元素原子的第一电离能由大到小的顺序是Mg>Al>Na.
(3)①DE3中心原子的杂化方式为sp3杂化,该分子中的键角比离子DE4+中的键角小的原因是孤电子对与成键电子对的排斥作用力大于成键电子对之间的排斥作用力
②将E的单质通入到黄血盐{K4[Fe(CN)6]}溶液中,可得到赤血盐{K3[Fe(CN)6]}.该反应的离子方程式为2[Fe(CN)6]4-+Cl2=2[Fe(CN)6]3-+2Cl-
③已知含E的一种化合物与过氧化氢发生如下反应(已配平):H2O2+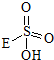 →
→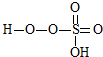 +HE,请写出横线上物质的结构式.
+HE,请写出横线上物质的结构式.
(4)F位于d区,价电子排布式为3d54s1.
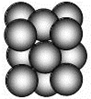
(5)G单质晶体中原子的堆积方式为面心立方最密堆积(如图),则晶胞中每个原子的配位数为12.假设晶胞边长为a,原子半径为r,列式表示该晶胞的空间利用率为$\frac{\sqrt{2}}{6}π$.
 现有六种元素,其中B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大.请根据下列相关信息,回答问题
现有六种元素,其中B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大.请根据下列相关信息,回答问题| B元素原子的核外p电子数比s电子数少1 |
| C原子的第一至第四电离能分别是: I1=738kJ/mol I2=1451kJ/mol I3=7733kJ/mol I4=10540kJ/mol |
| D原子核外所有p轨道全满或半满 |
| E元素的主族序数与周期数的差为4 |
| F 是前四周期原子电子轨道表示式中单电子数最多的元素 |
| G在周期表的第十一列 |
(2)C和与其左右相邻元素原子的第一电离能由大到小的顺序是Mg>Al>Na.
(3)①DE3中心原子的杂化方式为sp3杂化,该分子中的键角比离子DE4+中的键角小的原因是孤电子对与成键电子对的排斥作用力大于成键电子对之间的排斥作用力
②将E的单质通入到黄血盐{K4[Fe(CN)6]}溶液中,可得到赤血盐{K3[Fe(CN)6]}.该反应的离子方程式为2[Fe(CN)6]4-+Cl2=2[Fe(CN)6]3-+2Cl-
③已知含E的一种化合物与过氧化氢发生如下反应(已配平):H2O2+
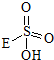 →
→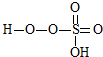 +HE,请写出横线上物质的结构式.
+HE,请写出横线上物质的结构式.(4)F位于d区,价电子排布式为3d54s1.
(5)G单质晶体中原子的堆积方式为面心立方最密堆积(如图),则晶胞中每个原子的配位数为12.假设晶胞边长为a,原子半径为r,列式表示该晶胞的空间利用率为$\frac{\sqrt{2}}{6}π$.
2. 25℃时,用NaOH粉末调节2a mol•L-1的氢氟酸水溶液的pH(忽略体积变化),得到c(HF)、c(F-)与溶液pH的变化关系如图所示.下列说法正确的是( )
25℃时,用NaOH粉末调节2a mol•L-1的氢氟酸水溶液的pH(忽略体积变化),得到c(HF)、c(F-)与溶液pH的变化关系如图所示.下列说法正确的是( )
 25℃时,用NaOH粉末调节2a mol•L-1的氢氟酸水溶液的pH(忽略体积变化),得到c(HF)、c(F-)与溶液pH的变化关系如图所示.下列说法正确的是( )
25℃时,用NaOH粉末调节2a mol•L-1的氢氟酸水溶液的pH(忽略体积变化),得到c(HF)、c(F-)与溶液pH的变化关系如图所示.下列说法正确的是( )| A. | 根据曲线可得Ka(HF)=0.01 | |
| B. | 当pH=3时,c(Na+)>c(F-) | |
| C. | 当pH=3.45时,2c(Na+)=c(F-)+c(HF) | |
| D. | 当pH=4时,溶液中:c(HF)+c(Na+)+c(H+)-c(OH-)=2a mol•L-1 |
1.在低温下电解饱和KHSO4溶液可制备K2S2O8,电解装置如图所示.下列说法不正确的是( )

| A. | 阳极的电极反应式为2SO42--2e-═S2O82- | |
| B. | 电解的总反应方程式为2KHSO4$\frac{\underline{\;通电\;}}{\;}$K2S2O8+H2↑ | |
| C. | 一段时间后,溶液的pH减小 | |
| D. | 电解过程中,阳极产生微量能使湿润的淀粉KI试纸变蓝的有色单质气体,该气体可能是O3 |
19. 常温下,0.2mol•L-1的一元酸HCl与等浓度的MOH溶液等体积混合后,所得溶液中部分微粒组成及浓度如图所示,下列说法正确的是( )
常温下,0.2mol•L-1的一元酸HCl与等浓度的MOH溶液等体积混合后,所得溶液中部分微粒组成及浓度如图所示,下列说法正确的是( )
 常温下,0.2mol•L-1的一元酸HCl与等浓度的MOH溶液等体积混合后,所得溶液中部分微粒组成及浓度如图所示,下列说法正确的是( )
常温下,0.2mol•L-1的一元酸HCl与等浓度的MOH溶液等体积混合后,所得溶液中部分微粒组成及浓度如图所示,下列说法正确的是( )| A. | MOH为强碱 | |
| B. | 该混合液pH=7 | |
| C. | 该混合溶液中:c(Cl-)=c(M+) | |
| D. | 图中X表示M+,Y表示H+,Y表示MOH,R表示OH- |
16.下面是某研究小组研究的关于不同催化剂对H2O2 分解反应的催化效率.
(1)写出H2O2 在催化剂作用下分解反应的化学方程式2H2O2$\frac{\underline{\;催化剂\;}}{\;}$2H2O+O2↑.
(2)从上表可以得出:活性炭、FeCl3、KI 和MnO2(粉末状)几种催化剂中,催化效率由大到小的顺序是MnO2(粉末状)>FeCl3>KI>活性炭,等质量的固体催化剂,颗粒大小对催化效率有什么影响颗粒越小催化效果越好.
(3)实验发现新鲜的动物肝脏对H2O2 的分解也有显著的催化作用,但当往溶液中加入盐酸,或给溶液加热时,就会失去催化能力,合理的解释是催化剂失去活性.
0 168384 168392 168398 168402 168408 168410 168414 168420 168422 168428 168434 168438 168440 168444 168450 168452 168458 168462 168464 168468 168470 168474 168476 168478 168479 168480 168482 168483 168484 168486 168488 168492 168494 168498 168500 168504 168510 168512 168518 168522 168524 168528 168534 168540 168542 168548 168552 168554 168560 168564 168570 168578 203614
| 催化剂(0.1g) | 活性炭 | FeCl3 | KI | MnO2颗粒状 | MnO2粉末状 |
| 前15s产生氧气的量(ml)[来 | 5 | 11 | 7 | 8[ | 11 |
| 前30s产生氧气的量(ml) | 8 | 16 | 11 | 11 | 21 |
| 前45s产生氧气的量(ml) | 11 | 20 | 15 | 18 | 35 |
| 前60s产生氧气的量(ml) | 15 | 24 | 20 | 26 | 49 |
(2)从上表可以得出:活性炭、FeCl3、KI 和MnO2(粉末状)几种催化剂中,催化效率由大到小的顺序是MnO2(粉末状)>FeCl3>KI>活性炭,等质量的固体催化剂,颗粒大小对催化效率有什么影响颗粒越小催化效果越好.
(3)实验发现新鲜的动物肝脏对H2O2 的分解也有显著的催化作用,但当往溶液中加入盐酸,或给溶液加热时,就会失去催化能力,合理的解释是催化剂失去活性.
 由于Fe(OH)2极易被氧化,所以实验室难用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀.若用如图所示实验装置可制得纯净的Fe(OH)2沉淀.两极材料分别为石墨和铁.
由于Fe(OH)2极易被氧化,所以实验室难用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀.若用如图所示实验装置可制得纯净的Fe(OH)2沉淀.两极材料分别为石墨和铁.