题目内容
19. 常温下,0.2mol•L-1的一元酸HCl与等浓度的MOH溶液等体积混合后,所得溶液中部分微粒组成及浓度如图所示,下列说法正确的是( )
常温下,0.2mol•L-1的一元酸HCl与等浓度的MOH溶液等体积混合后,所得溶液中部分微粒组成及浓度如图所示,下列说法正确的是( )| A. | MOH为强碱 | |
| B. | 该混合液pH=7 | |
| C. | 该混合溶液中:c(Cl-)=c(M+) | |
| D. | 图中X表示M+,Y表示H+,Y表示MOH,R表示OH- |
分析 一元酸HCl和MOH溶液等体积、等浓度0.2mol/L混合,HCl+MOH=MCl+H2O,所得溶液中Cl-浓度等于0.1mol/L,而其它微粒都小于0.1mol/L,说明在溶液中存在M++H2O?MOH+H+,MCl水解,MOH为弱碱,MCl溶液呈酸性,则c(OH-)<c(H+),一般来说,盐类的水解程度较低,则有c(M+)>c(H+),所以:c(Cl-)=0.1mol/L>c(M+)>c(H+)>c(MOH)>c(OH-),X表示M+,Y表示H+,Y表示MOH,R表示OH-.
解答 解:一元酸HCl和MOH溶液等体积、等浓度0.2mol/L混合,HCl+MOH=MCl+H2O,所得溶液中Cl-浓度等于0.1mol/L,而其它微粒都小于0.1mol/L,说明在溶液中存在M++H2O?MOH+H+,MCl水解,MOH为弱碱,MCl溶液呈酸性,则c(OH-)<c(H+),一般来说,盐类的水解程度较低,则有c(M+)>c(H+),所以:c(Cl-)=0.1mol/L>c(M+)>c(H+)>c(MOH)>c(OH-),X表示M+,Y表示H+,Y表示MOH,R表示OH-,
A、MOH为弱碱,故A错误;
B、在溶液中存在M++H2O?MOH+H+,MCl水解,MOH为弱碱,MCl溶液呈酸性,故B错误;
C、溶液中存在M++H2O?MOH+H+,而氯离子是强离子,所以:c(Cl-)=0.1mol/L>c(M+),故C错误;
D、因为c(Cl-)=0.1mol/L>c(M+)>c(H+)>c(MOH)>c(OH-),所以X表示M+,Y表示H+,Y表示MOH,R表示OH-,故D正确;
故选D.
点评 本题考查了酸碱混合溶液定性判断,根据酸的强弱结合物料守恒解答,考查离子浓度大小比较、溶液PH值、盐类水解等,判断MOH是一元弱碱为解题关键,题目难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | 5种 | B. | 6种 | C. | 7种 | D. | 8种 |
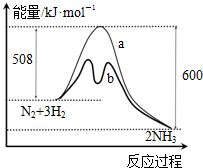
| A. | 升高温度可增大正反应速率,降低逆反应速率 | |
| B. | 正反应的活化能大于逆反应的活化能 | |
| C. | a曲线是未加入催化剂时的能量变化曲线 | |
| D. | 该反应的热化学方程式为:2NH3?N2+3H2△H=-92 kJ•mol-1 |
| X | 动植物生产不可缺少的元素,是蛋白质的重要成分 |
| Y | 地壳中含量居第一位 |
| Z | 短周期中其原子半径最大 |
| Q | 生活中大量使用其合金制品,工业上可用电解其氧化物的方法制备 |
| M | 海水中大量富集的元素之一,其最高正价与负价的代数和为6 |
 .
.(2)已知37Rb和53I都位于第五周期,分别与Z和M位于同一主族.下列有关说法正确的是ACD(填序号).
A.原子半径:Rb>I
B.RbM中含有共价键
C.气态氢化物热稳定性:M>I
D.Rb、Q、M的最高价氧化物对应的水化物可以两两发生反应
(3)X、Y组成的一种无色气体遇空气变为红棕色.将标准状况下40L该无色气体与15L氧气通入一定浓度的NaOH溶液中,恰好被完全吸收,同时生成两种盐.请写出该反应的离子方程式:8NO+3O2+8OH-=2NO3-+6NO2-+4H2O.
| A. | 39.1% | B. | 24.6% | C. | 16.4% | D. | 无法确定 |
| A. | 浓的氢氟酸溶液中存在HF${\;}_{2}^{-}$和H2F${\;}_{3}^{-}$ | |
| B. | SiH4沸点比CH4高 | |
| C. | 水和乙醇分别与金属钠反应,前者比后者剧烈 | |
| D. | H2O比H2S稳定,前者1000℃以上才分解,后者300℃分解 |
| A. | 氨水 | B. | NaOH溶液 | C. | NaCl溶液 | D. | NH4Cl溶液 |
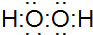 .
. .
. .
. .
.