题目内容
17.完成下列热化学方程式(化学方程式、电极反应式、表达式等)的书写:(1)已知:2Cu(s)+$\frac{1}{2}$O2(g)=Cu2O(s);△H=-169kJ•mol-1,
C(s)+$\frac{1}{2}$O2(g)=CO(g);△H=-110.5kJ•mol-1,
Cu(s)+$\frac{1}{2}$O2(g)=CuO(s);△H=-157kJ•mol-1
用炭粉在高温条件下还原CuO生成Cu2O固体和CO的热化学方程式是:C(s)+2CuO(s)=Cu2O(s)+CO(g)△H=+34.5KJ/mol.
(2)镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用,该电池的电解质溶液为KOH溶液,它的充、放电反应按正式进行:Cd+2NiOOH+2H2O$?_{充电}^{放电}$Cd(OH)2+2Ni(OH)2,已知Ni(OH)2、Cd(OH)2、NiOOH都难溶于KOH溶液.请写出该电池在放电时的负极电极反应式:Cd-2e-+2OH-=Cd(OH)2和充电时的阳极电极反应式:Ni(OH)2-e-+OH-=NiOOH+H2O.
(3)以甲烷、空气为反应物,KOH溶液作电解质溶液构成燃料电池,则负极反应式为:CH4+10OH--8e-=CO32-+7H2O.用该燃料电池电解水,当消耗1mol甲烷时可生成H24mol.
分析 (1)据盖斯定律,利用已知热化学方程式构建待求热化学方程式解答;
(2)原电池中,负极上发生失电子的氧化反应,充电时为电解池,电解池中,与直流电源正极相连的电极是阳极,阳极发生失电子的氧化反应;
(3)甲烷燃料电池中,负极上是甲烷发生失电子的氧化反应,正极上是氧气发生得电子的还原反应,又因为电解质是KOH溶液,不会在电极上放出二氧化碳;据电子守恒计算生成氢气的物质的量.
解答 解:(1)已知:①2Cu(s)+$\frac{1}{2}$O2(g)=Cu2O(s);△H=-169kJ•mol-1,
②C(s)+$\frac{1}{2}$O2(g)=CO(g);△H=-110.5kJ•mol-1,
③Cu(s)+$\frac{1}{2}$O2(g)=CuO(s);△H=-157kJ•mol-1
据盖斯定律,①+②-2×③得:C(s)+2CuO(s)=Cu2O(s)+CO(g)△H=+34.5KJ/mol,故答案为:C(s)+2CuO(s)=Cu2O(s)+CO(g)△H=+34.5KJ/mol;
(2)放电时是原电池工作原理,负极上发生失电子的氧化反应,即Cd-2e-+2OH-=Cd(OH)2,充电时是电解池的工作原理,电解池中,与直流电源正极相连的电极是阳极,阳极发生失电子的氧化反应,即发生Ni(OH)2转化为NiO(OH)的反应:Ni(OH)2-e-+OH-=NiOOH+H2O,
故答案为:Cd-2e-+2OH-=Cd(OH)2;Ni(OH)2-e-+OH-=NiOOH+H2O;
(3)甲烷燃料电池以KOH溶液为电解质溶液时,负极上是甲烷发生失电子的氧化反应,又因为电解质是KOH溶液,二氧化碳和氢氧化钾反应得到的是碳酸钾,即CH4+10OH--8e-=CO32-+7H2O,消耗1mol甲烷时,转移8mol电子,电解水时,每转移2mol电子生成1mol氢气,所以转移8mol电子,生成4mol氢气,
故答案为:CH4+10OH--8e-=CO32-+7H2O;4.
点评 本题考查了盖斯定律的应用、原电池和电解池中电极反应式的书写、电化学中电子守恒的应用,题目难度不大.

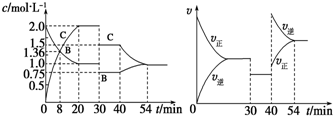
| A. | 8 min时表示正反应速率等于逆反应速率 | |
| B. | 前20 min A的反应速率为0.05 mol•L-1•min-1 | |
| C. | 反应方程式中的x=1,30 min时表示增大压强 | |
| D. | 40 min时改变的条件是升高温度,且正反应为吸热反应 |
| A. | O2与O3互为同位素 | |
| B. | O2与O3的相互转化是物理变化 | |
| C. | 在相同的温度与压强下,等体积的O2与O3含有相同的分子数 | |
| D. | 等物质的量的O2与O3含有相同的质子数 |
| A. | 铝和氢氧化钠溶液反应:2Al+2OH-=2AlO2-+H2↑ | |
| B. | 铜与足量FeCl3溶液反应:Fe3++Cu=Fe2++Cu2+ | |
| C. | 用醋酸除去水瓶中的水垢:CaCO3+2H+=Ca2++H2O+CO2↑ | |
| D. | 向苯酚钠溶液中通入CO2:C6H5O-+CO2+H2O→C6H5OH+HCO3- |
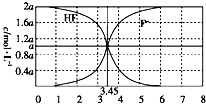 25℃时,用NaOH粉末调节2a mol•L-1的氢氟酸水溶液的pH(忽略体积变化),得到c(HF)、c(F-)与溶液pH的变化关系如图所示.下列说法正确的是( )
25℃时,用NaOH粉末调节2a mol•L-1的氢氟酸水溶液的pH(忽略体积变化),得到c(HF)、c(F-)与溶液pH的变化关系如图所示.下列说法正确的是( )| A. | 根据曲线可得Ka(HF)=0.01 | |
| B. | 当pH=3时,c(Na+)>c(F-) | |
| C. | 当pH=3.45时,2c(Na+)=c(F-)+c(HF) | |
| D. | 当pH=4时,溶液中:c(HF)+c(Na+)+c(H+)-c(OH-)=2a mol•L-1 |
| A. | 4v(NH3)=5(O2) | B. | 4 v(NH3)=6 v(H2O) | C. | 4v(O2)=5 v(NO) | D. | 4 v(NH3)=5 v(NO) |
| A. | υ(A)=0.5 mol•(L•s)-1 | B. | υ(B)=0.3 mol•(L•s)-1 | ||
| C. | υ(C)=0.8 mol•(L•s)-1 | D. | υ(D)=1 mol•(L•s)-1 |
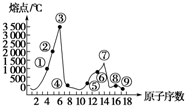 如图是部分短周期元素的单质熔点的变化图,根据此图,填写下列空格:
如图是部分短周期元素的单质熔点的变化图,根据此图,填写下列空格: .
.