14.下列各反应的离子方程式中,错误的是( )
| A. | 硫酸铝溶液中加入过量的氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| B. | 金属钠投入水中:Na+H2O═Na++OH-+H2↑ | |
| C. | 将铝片放入过量NaOH溶液中:2Al+2OH-+2H2O═2AlO2-+3H2↑ | |
| D. | 氧化铝溶于NaOH溶液:Al2O3+2OH-═2AlO2-+H2O |
11.下列各组性质比较中,不正确的是( )
| A. | 酸性:HClO4>HBrO4>HIO4 | B. | 碱性:Ba(OH)2>Mg(OH)2>Be(OH)2 | ||
| C. | 非金属性:F>C>O | D. | 气态氢化物稳定性:HF>HCl>H2S |
10.原电池的总反应为:Zn+H2SO4=ZnSO4+H2↑,负极上发生反应的物质是( )
| A. | H2SO4 | B. | Zn | C. | ZnSO4 | D. | H2 |
9.下列说法中不正确的是( )
| A. | 原电池中电子流出的一极为正极,发生氧化反应 | |
| B. | 原电池是将化学能转化为电能的装置 | |
| C. | 原电池中阴离子向负极移动 | |
| D. | 原电池正极上发生还原反应 |
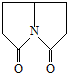
6.普拉西坦(如图)是一种能改善记忆、抗健忘的中枢神经药.下列关于普拉西坦的说法不正确的是( )
0 168379 168387 168393 168397 168403 168405 168409 168415 168417 168423 168429 168433 168435 168439 168445 168447 168453 168457 168459 168463 168465 168469 168471 168473 168474 168475 168477 168478 168479 168481 168483 168487 168489 168493 168495 168499 168505 168507 168513 168517 168519 168523 168529 168535 168537 168543 168547 168549 168555 168559 168565 168573 203614

| A. | 一氯取代物有5种 | B. | 二氯取代物有8种 | C. | 可发生水解反应 | D. | 该物质中有羰基 |
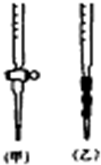 阅读下列实验内容,根据题目要求回答问题.
阅读下列实验内容,根据题目要求回答问题.
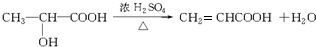
 .
.