题目内容
11.下列各组性质比较中,不正确的是( )| A. | 酸性:HClO4>HBrO4>HIO4 | B. | 碱性:Ba(OH)2>Mg(OH)2>Be(OH)2 | ||
| C. | 非金属性:F>C>O | D. | 气态氢化物稳定性:HF>HCl>H2S |
分析 A、元素的非金属性越强,则其最高价含氧酸的酸性越强;
B、金属性越强,则其最高价氧化物水化物的碱性越强;
C、同周期从左到右非金属性增强;
D、非金属性越强,则气态氢化物越稳定.
解答 解:A、元素的非金属性越强,则其最高价含氧酸的酸性越强,非金属性:Cl>Br>I,则酸性:HClO4>HBrO4>HIO4,故A正确;
B、金属性越强,则其最高价氧化物水化物的碱性越强,金属性:Ba>Mg>Be,则碱性:Ba(OH)2>Mg(OH)2>Be(OH)2,故B正确;
C、同周期从左到右非金属性增强,非金属性:F>O>C,故C错误;
D、非金属性越强,则气态氢化物越稳定,非金属性:F>Cl>S,则气态氢化物稳定性:HF>HCl>H2S,故D正确;
故选C.
点评 本题考查了非金属和金属性的比较,明确常见的比较的方法是解答本题的关键,注意知识的归纳整理,题目难度不大.

练习册系列答案
 小题狂做系列答案
小题狂做系列答案
相关题目
19.下列现象中,不是因为发生化学反应而产生的是( )
| A. | 乙烯使酸性KMnO4溶液褪色 | |
| B. | 将苯滴入溴水中,振荡后水层接近无色 | |
| C. | 乙烯使溴的四氯化碳溶液褪色 | |
| D. | 淀粉遇碘水变蓝 |
6.普拉西坦(如图)是一种能改善记忆、抗健忘的中枢神经药.下列关于普拉西坦的说法不正确的是( )
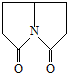

| A. | 一氯取代物有5种 | B. | 二氯取代物有8种 | C. | 可发生水解反应 | D. | 该物质中有羰基 |
20.下列叙述中不正确的是( )
| A. | 电能是二级能源 | B. | 水力是一级能源 | ||
| C. | 煤、石油、天然气是一级能源 | D. | 水煤气是一级能源 |
16.已知短周期元素的离子:aA2+、bB+、cC2-、dD-具有相同的电子层结构,则下列说法正确的是( )
| A. | A元素与C元素在同一周期 | B. | 原子半径:A>B>C>D | ||
| C. | b=d+2 | D. | 离子半径:D->C2->B+>A2+ |
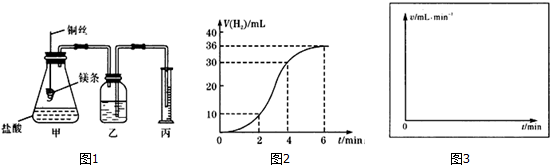
 某化学兴趣小组利用如图装置验证元素非金属性的变化规律.
某化学兴趣小组利用如图装置验证元素非金属性的变化规律.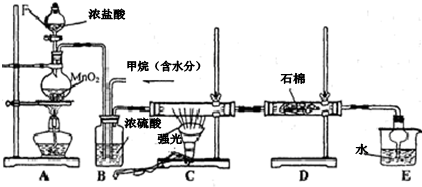
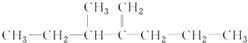 ,此烃名称为3-甲基-2-丙基-1-戊烯.
,此烃名称为3-甲基-2-丙基-1-戊烯.