题目内容
7.18℃时,H2A(酸):K1=4.3×10-7,K2=2.1×10-12.H2B(酸):K1=1.0×10-7,K2=6.3×10-13,在浓度相同的两种溶液中,用“>”、“<”或“=”填空.(1)酸根离子的浓度:c (A2-)>c (B2-);
(2)溶液的导电能力:H2A>H2B.
分析 (1)相同温度、相同浓度下,电离平衡常数越大其电离程度越大;
(2)溶液导电能力与离子浓度成正比,据此回答.
解答 解:(1)相同温度、相同浓度下,电离平衡常数越大其电离程度越大,H2A(酸)的K2大于H2B(酸),所以酸根离子的浓度:c(A2-)>c(B2-),故答案为:>;
(2)相同温度、相同浓度的不同二元酸溶液中,c(H+)与电离平衡常数成正比,多元弱酸的电离以第一步为主,H2A(酸)的K1大于H2B(酸),所以H2A电离程度大,溶液中离子浓度H2A>H2B,溶液的导电能力:H2A>H2B,
故答案为:>.
点评 本题考查弱电解质的电离,明确电离平衡常数与电离程度关系是解本题关键,注意溶液导电能力与离子浓度成正比,与电解质强弱无关,为易错点.

练习册系列答案
 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案
相关题目
17.已知可逆反应2SO2+O2 $?_{△}^{催化剂}$2SO3,当生成2mol SO3时放出热量为Q,现将1mol SO2和0.5mol O2在相同条件下反应生成SO3放出的热量为Q1,则( )
| A. | Q1=Q | B. | Q1<Q | C. | 2Q1<Q | D. | 无法判断 |
18.根据下列事实所作的结论,正确的是( )
| 编号 | 事实 | 结论 |
| A | 甲、乙两种有机物具有相同相对分子质量和不同结构 | 甲和乙一定是同分异构体 |
| B | 质量相同的甲、乙两种烃完全燃烧时产生质量相同的水 | 甲、乙两种分子一定是同分异构体 |
| C | 致冷剂氟里昂(二氯二氟甲烷)不存在同分异构体 | 甲烷分子为正四面体构型 |
| D | 将C2H5Br与NaOH醇溶液共热后的气体直接通入酸性KMnO4溶液,紫红色褪去 | 使KMnO4褪色的一定是C2H4 |
| A. | A | B. | B | C. | C | D. | D |
2.尿黑酸是由酪氨酸在人体内非正常代谢而产生的一种物质.其转化过程如下:
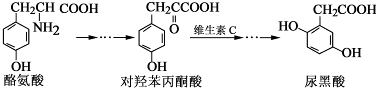
下列说法错误的是( )

下列说法错误的是( )
| A. | 对羟基苯丙酮酸分子中在同一平面上的碳原子至少有7个 | |
| B. | 1 mol尿黑酸与足量浓溴水反应,最多消耗3molBr2 | |
| C. | 酪氨酸既能与盐酸反应,又能与氢氧化钠反应 | |
| D. | 1 mol尿黑酸与足量NaHCO3反应,最多消耗3 molNaHCO3 |
19.对于放热反应H2+Cl2$\frac{\underline{\;点燃\;}}{\;}$2HCl,下列说法中,正确的是( )
| A. | 产物所具有的总能量高于反应物所具有的总能量 | |
| B. | 反应物所具有的总能量高于产物所具有的总能量 | |
| C. | 断开1 mol H-H键和1 mol Cl-Cl键所吸收的总能量大于形成1mol H-Cl键所放出的能量 | |
| D. | 该反应中,化学能只转变为热能 |
16.下表列出了①~⑨九种元素在周期表中的位置.请回答(用化学用语):
(1)在这些元素中,最活泼的金属元素是K;最活泼非金属元素是O;最不活泼的元素是Ar.
(2)这些元素的最高价氧化物对应的水化物中,酸性最强的化合物的分子式是HClO4;碱性最强的化合物的电子式 ;能形成两性氢氧化物的元素是Al.
;能形成两性氢氧化物的元素是Al.
(3)①、②、③三种元素的原子半径由大到小的顺序依次为K>Na>Mg.
(4)⑥元素的氢化物是H2O,该氢化物在常温下与②发生反应的化学方程式为2K+2H2O=2KOH+H2↑,所得溶液的pH> 7.
(5)用电子式表示①和⑧元素形成化合物的过程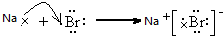 .
.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ⑤ | ⑥ | ||||||
| 3 | ① | ③ | ④ | ⑦ | ⑨ | |||
| 4 | ② | ⑧ |
(2)这些元素的最高价氧化物对应的水化物中,酸性最强的化合物的分子式是HClO4;碱性最强的化合物的电子式
 ;能形成两性氢氧化物的元素是Al.
;能形成两性氢氧化物的元素是Al.(3)①、②、③三种元素的原子半径由大到小的顺序依次为K>Na>Mg.
(4)⑥元素的氢化物是H2O,该氢化物在常温下与②发生反应的化学方程式为2K+2H2O=2KOH+H2↑,所得溶液的pH> 7.
(5)用电子式表示①和⑧元素形成化合物的过程
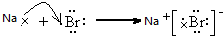 .
.
12.有机反应的类型很多,下列各反应中与CH2=CH2→CH2Br-CH2Br的变化属于同一反应类型的是( )
| A. | C2H5Cl→CH2=CH2 | B. |  → → | ||
| C. | CH≡CH→CH2=CH2 | D. | CH3COOH→CH3COOC2H5 |
 有机化合物的化学性质本质上就是分子结构中所含官能团的性质:
有机化合物的化学性质本质上就是分子结构中所含官能团的性质: ;
;