题目内容
14.下列各反应的离子方程式中,错误的是( )| A. | 硫酸铝溶液中加入过量的氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| B. | 金属钠投入水中:Na+H2O═Na++OH-+H2↑ | |
| C. | 将铝片放入过量NaOH溶液中:2Al+2OH-+2H2O═2AlO2-+3H2↑ | |
| D. | 氧化铝溶于NaOH溶液:Al2O3+2OH-═2AlO2-+H2O |
分析 A.反应生成氢氧化铝和硫酸铵;
B.电子、原子不守恒;
B.反应生成偏铝酸钠和氢气;
D.反应生成偏铝酸钠和水.
解答 解:A.硫酸铝溶液中加入过量的氨水的离子反应为Al3++3NH3•H2O═Al(OH)3↓+3NH4+,故A正确;
B.金属钠投入水中的离子反应为2Na+2H2O═2Na++2OH-+H2↑,故B错误;
C.将铝片放入过量NaOH溶液中的离子反应为2Al+2OH-+2H2O═2AlO2-+3H2↑,故C正确;
D.氧化铝溶于NaOH溶液的离子反应为Al2O3+2OH-═2AlO2-+H2O,故D正确;
故选B.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应、与量有关的离子反应考查,综合性较强,注意氢氧化铝的两性,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
5.金刚石和石墨是由碳元素组成的两种结构不同的单质(同素异形体).在100kPa时,1mol石墨转化为金刚石,要吸收1.895kJ的热能.据此,试判断在100kPa压强下,下列结论正确的是( )
| A. | 石墨比金刚石稳定 | |
| B. | 金刚石比石墨稳定 | |
| C. | 1 mol石墨比1 mol金刚石的总能量高 | |
| D. | 1 mol石墨与1 mol金刚石的总能量一样高 |
2.尿黑酸是由酪氨酸在人体内非正常代谢而产生的一种物质.其转化过程如下:
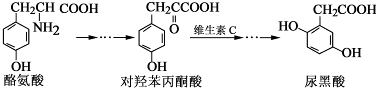
下列说法错误的是( )

下列说法错误的是( )
| A. | 对羟基苯丙酮酸分子中在同一平面上的碳原子至少有7个 | |
| B. | 1 mol尿黑酸与足量浓溴水反应,最多消耗3molBr2 | |
| C. | 酪氨酸既能与盐酸反应,又能与氢氧化钠反应 | |
| D. | 1 mol尿黑酸与足量NaHCO3反应,最多消耗3 molNaHCO3 |
9.下列说法中不正确的是( )
| A. | 原电池中电子流出的一极为正极,发生氧化反应 | |
| B. | 原电池是将化学能转化为电能的装置 | |
| C. | 原电池中阴离子向负极移动 | |
| D. | 原电池正极上发生还原反应 |
19.对于放热反应H2+Cl2$\frac{\underline{\;点燃\;}}{\;}$2HCl,下列说法中,正确的是( )
| A. | 产物所具有的总能量高于反应物所具有的总能量 | |
| B. | 反应物所具有的总能量高于产物所具有的总能量 | |
| C. | 断开1 mol H-H键和1 mol Cl-Cl键所吸收的总能量大于形成1mol H-Cl键所放出的能量 | |
| D. | 该反应中,化学能只转变为热能 |
19.X、Y两元素可形成X2Y3型化合物,则X、Y原子最外层的电子排布可能是( )
| A. | X:3s23P1 Y:3s23P5 | B. | X:2s22P3Y:2s22P4 | ||
| C. | X:3s23P2 Y:3s23P3 | D. | X:3s2 Y:2s22P3 |

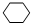
 +Br2→
+Br2→ .
.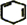 +2NaBr+2H2O.
+2NaBr+2H2O.
 (用电子式表示).
(用电子式表示).