题目内容
8. 阅读下列实验内容,根据题目要求回答问题.
阅读下列实验内容,根据题目要求回答问题.某学生为测定未知浓度的硫酸溶液,实验如下:用1.00mL待测硫酸配制100mL稀H2SO4溶液;以0.14mol•L-1的NaOH溶液滴定上述稀H2SO4 25.00mL,滴定终止时消耗NaOH溶液15.00mL.
(1)该学生用标准0.14mol•L-1 NaOH溶液滴定硫酸的实验操作如下:
A、用酸式滴定管取稀H2SO4 25.00mL,注入锥形瓶中,加入2滴酚酞.
B、用待测定的溶液润洗酸式滴定管
C、用蒸馏水洗干净滴定管
D、取下碱式滴定管用标准的NaOH溶液润洗后,将标准液注入碱式滴定管刻度“0”以上2-3cm处,再把碱式滴定管固定好,调节液面至 刻度“0”或“0”刻度以下
E、检查滴定管是否漏水
F、另取锥形瓶,再重复操作一次
G、把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度
则滴定操作的正确顺序是(用序号填写)E→C→D→B、A→G→F;
(2)在G操作中如何确定终点?溶液由无色变粉红色,且半分钟内不变色.
(3)碱式滴定管用蒸馏水润洗后,未用标准液润洗导致滴定结果(填“偏小”、“偏 大”或“恰好合适”)偏大.
(4)配制准确浓度的稀H2SO4溶液,必须使用的定量容器是:100mL容量瓶.
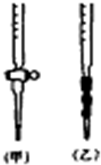
(5)用标准NaOH溶液滴定时,应将标准NaOH溶液注入乙(选填“甲”或“乙”)中.(右图)
(6)观察碱式滴定管读数时,若滴定前仰视,滴定后俯视,则结果会导致测得的稀H2SO4溶液浓度测定值偏小(填“偏大”“偏小”或“无影响”).
(7)计算待测硫酸(稀释前的硫酸)溶液的物质的量浓度4.20mol/L(计算结果到小数点后二位).
分析 (1)根据中和滴定有检漏、洗涤、润洗、装液、调零、取待测液并加指示剂、滴定等操作分析;
(2)根据滴定结束前硫酸溶液的颜色及反应结束后混合液的颜色变化判断滴定终点;
(3)碱式滴定管用蒸馏水润洗后,未用标准液润洗,则氢氧化钠溶液的浓度变小;
(4)配制100mL溶液用到100mL的容量瓶;
(5)碱性溶液盛放在碱式滴定管中;
(6)观察碱式滴定管读数时,若滴定前仰视,滴定后俯视,则氢氧化钠的体积偏小;
(7)根据滴定消耗的氢氧化钠溶液的体积及反应方程式计算出待测液硫酸的物质的量及浓度.
解答 解:(1)中和滴定有检漏、洗涤、润洗、装液、调零、取待测液并加指示剂、滴定等操作,所以滴定操作的正确顺序是E、C、D、B、A、G、F;
故答案为:B、A、G;
(2)用氢氧化钠滴定硫酸,用酚酞作指示剂时,溶液由无色变粉红色,且半分钟内不变色,则到达滴定终点;
故答案为:溶液由无色变粉红色,且半分钟内不变色;
(3)碱式滴定管用蒸馏水润洗后,未用标准液润洗,则氢氧化钠溶液的浓度变小,滴定时消耗的氢氧化钠的体积偏大,所以计算结果偏大;
故答案为:偏大;
(4)配制100mL溶液用到100mL的容量瓶,则配制准确浓度的稀H2SO4溶液,必须使用的定量容器是100mL容量瓶;
故答案为:100mL容量瓶;
(5)碱性溶液盛放在碱式滴定管中,所以标准NaOH溶液注入碱式滴定管中,即乙图;
故答案为:乙;
(6)观察碱式滴定管读数时,若滴定前仰视,滴定后俯视,则氢氧化钠的体积偏小,所以测定的硫酸的浓度偏小;
故答案为:偏小;
(7)滴定时消耗的氢氧化钠的物质的量为n(NaOH)=cV=0.14mol•L-1×0.01500L
根据反应:2NaOH+H2SO4=Na2SO4+2H2O,则:n(H2SO4)=$\frac{1}{2}$n(NaOH)=$\frac{1}{2}$×0.14mol•L-1×0.01500L,
所以100mL硫酸中物质的量为$\frac{1}{2}$×0.14mol•L-1×0.01500L×$\frac{100mL}{25mL}$=0.0042mol,
则待测硫酸(稀释前的硫酸)溶液的物质的量浓度c=$\frac{0.0042mol}{0.001L}$=4.20mol/L;
故答案为:4.20mol/L.
点评 本题考查了酸碱中和滴定,题目难度中等,涉及了实验步骤、滴定方法、误差分析、浓度计算等知识,注意掌握误差分析的方法,侧重于考查学生的分析能力和计算能力.

(1)单位时间内生成nmolO2的同时生成2nmolNO2
(2)单位时间内生成nmolO2的同时,生成2nmolNO
(3)用NO2、NO、O2的物质的量浓度变化表示反应速率的比为2:2:1的状态
(4)混合气体的颜色不再改变的状态.
| A. | (1)(4) | B. | (2)(3) | C. | (1)(3)(4) | D. | (1)(2)(3)(4) |
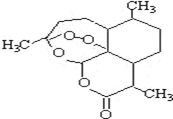 被誉为中国“新四大发明”的复方蒿甲醚是第一个由中国发现的全新化学结构的药品,也是目前在国际上获得广泛认可的中国原创药品.截至2005年底,已被26个亚非国家指定为疟疾治疗一线用药,它在疟疾这一高传染性疾病治疗史上具有里程碑意义.其主要成分是青蒿素(是一种由青蒿中分离得到的具有新型化学结构的抗疟药),结构如图所示.有关该化合物的叙述正确的是( )
被誉为中国“新四大发明”的复方蒿甲醚是第一个由中国发现的全新化学结构的药品,也是目前在国际上获得广泛认可的中国原创药品.截至2005年底,已被26个亚非国家指定为疟疾治疗一线用药,它在疟疾这一高传染性疾病治疗史上具有里程碑意义.其主要成分是青蒿素(是一种由青蒿中分离得到的具有新型化学结构的抗疟药),结构如图所示.有关该化合物的叙述正确的是( )| A. | 分子式为:C16H22O5 | |
| B. | 该化合物在一定条件下不能与NaOH溶液反应 | |
| C. | 该化合物中含有过氧键,一定条件下有氧化性 | |
| D. | 青蒿素易溶于水 |
| A. | [Co(NH3)3Cl3] | B. | [Co(NH3)6]Cl3 | C. | [Co(NH3)4Cl2]Cl | D. | [Co(NH3)5Cl]Cl2 |
| A. | 离子键 | B. | π键 | C. | 配位键 | D. | 氢键 |
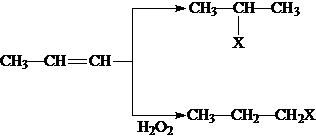 (X为溴原子)
(X为溴原子) 的物质,该物质是一种香料.
的物质,该物质是一种香料.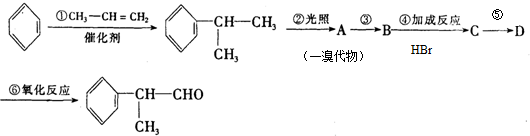
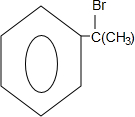
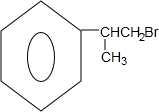 .
. 、
、 、
、 任意1种.
任意1种.