3.下面判断不正确的是( )
| A. | 二氧化硫是可燃性气体,因它能与O2反应 | |
| B. | FeSO4可以作为净水剂 | |
| C. | 洒落在地上的汞可在其表面撒硫磺除去 | |
| D. | 重晶石是硫酸盐 |
2.实验室下列物质的保存方法中,不正确的是( )
| A. | 铝片放在不密封的容器里 | |
| B. | 氢氧化钠溶液盛装在用玻璃塞的试剂瓶中 | |
| C. | 硫酸亚铁溶液存放在加有少量铁粉的试剂瓶中 | |
| D. | 金属钠保存在石蜡油或煤油中 |
1.将等物质的量的A、B混合于2L的恒容密闭容器中,发生如下反应:3A(g)+B(g)?xC(g)+2D(g),经5min后,测得D的量为1mol,C的平均反应速率是0.1mol/(L•min).则x的值为( )
| A. | 1 | B. | 2 | C. | 3 | D. | 4 |
20.将一定质量的镁、铜组成的混合物加入到稀硝酸中,金属完全溶解(假设反应中还原产物全部是NO).向反应后的溶液中加入3mol/LNaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加7.65g,则下列叙述中正确的是( )
| A. | 当生成沉淀达到最大量时,消耗NaOH溶液的体积为150mL | |
| B. | 当金属全部溶解时收集到NO气体的体积为0.336L(标准状况下) | |
| C. | 当金属全部溶解时,参加反应的硝酸的物质的量一定是0.6mol | |
| D. | 参加反应的金属的总质量一定是9.9g |
19.电负性的大小也可以作为判断元素金属性和非金属性强弱的尺度.下列关于电负性的变化规律正确的是( )
| A. | 周期表从左到右,元素的电负性逐渐变大 | |
| B. | 周期表从上到下,元素的电负性逐渐变大 | |
| C. | 电负性越大,金属性越强 | |
| D. | 电负性越小,非金属性越强 |
18. 高温下,超氧化钾晶体呈立方体结构,晶体中氧的化合价部分为0价,部分为-2价.如右图所示为超氧化钾晶体的一个晶胞,则下列说法正确的是( )
高温下,超氧化钾晶体呈立方体结构,晶体中氧的化合价部分为0价,部分为-2价.如右图所示为超氧化钾晶体的一个晶胞,则下列说法正确的是( )
 高温下,超氧化钾晶体呈立方体结构,晶体中氧的化合价部分为0价,部分为-2价.如右图所示为超氧化钾晶体的一个晶胞,则下列说法正确的是( )
高温下,超氧化钾晶体呈立方体结构,晶体中氧的化合价部分为0价,部分为-2价.如右图所示为超氧化钾晶体的一个晶胞,则下列说法正确的是( )| A. | 超氧化钾的化学式为KO2,每个晶胞含有4个K+和4个O2- | |
| B. | 晶体中每个K+周围有8个O2-,每个O2-周围有8个K+ | |
| C. | 晶体中与每个K+距离最近的K+有8个 | |
| D. | 晶体中与每个K+距离最近的K+有6个 |
17.根据如图提供的信息,下列所得结论正确的是( )
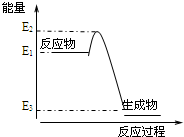

| A. | 该反应为吸热反应 | B. | 该反应向外界放出的热量为E1-E3 | ||
| C. | 该反应一定可以设计成为原电池 | D. | 该反应向外界放出的热量为E2-E3 |
16.下列有关粒子半径的叙述正确的是( )
| A. | 电子层结构相同的粒子随核电荷的递增半径逐渐增大 | |
| B. | CsCl、NaBr、CaF2、LiI四种化合物中LiI的阴阳离子半径之比值最大 | |
| C. | S2-半径小于硫原子半径 | |
| D. | 无法比较K+、Al3+、O2-、Cl-的半径大小 |
15.下列有关碱金属的说法正确的是( )
| A. | 碱金属元素随原子序数的递增原子半径逐渐减小 | |
| B. | 碱金属元素随原子序数的递增离子氧化性逐渐减弱 | |
| C. | 碱金属元素的单质在氧气点燃都生成过氧化物 | |
| D. | 碱金属元素随原子序数的递增最高价氧化物对应的水化物碱性逐渐减弱 |
14.下列说法中,正确的是( )
0 168344 168352 168358 168362 168368 168370 168374 168380 168382 168388 168394 168398 168400 168404 168410 168412 168418 168422 168424 168428 168430 168434 168436 168438 168439 168440 168442 168443 168444 168446 168448 168452 168454 168458 168460 168464 168470 168472 168478 168482 168484 168488 168494 168500 168502 168508 168512 168514 168520 168524 168530 168538 203614
| A. | 甲醇、乙二醇、丙三醇都易溶于水且都有剧毒 | |
| B. | 按甲醇、乙二醇、丙三醇的顺序,其沸点逐渐升高 | |
| C. | 相同质量的甲醇、乙二醇、丙三醇与足量钠反应,甲醇放出氢气最多 | |
| D. | 甲醇、乙二醇、丙三醇都能发生取代、消去、氧化反应 |