题目内容
17.根据如图提供的信息,下列所得结论正确的是( )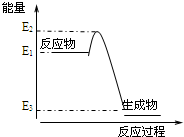
| A. | 该反应为吸热反应 | B. | 该反应向外界放出的热量为E1-E3 | ||
| C. | 该反应一定可以设计成为原电池 | D. | 该反应向外界放出的热量为E2-E3 |
分析 A.根据反应物的总能量和生成物的总能量的相对大小来判断;
B.此反应的反应热为E1-E3;
C.理论上讲,任何自发的氧化还原反应都可以设计成原电池;
D.放出的热量=反应物的总能量-生成物的总能量.
解答 解:A.若反应物的总能量>生成物的总能量,则反应为放热反应,若反应物的总能量>生成物的总能量,则反应为吸热热反应,故该反应为放热反应,故A错误;
B.此反应非反应热为E1-E3,即放出热量为E1-E3,故B正确;
C.理论上讲,任何自发的氧化还原反应都可以设计成原电池,该反应是放热反应但不一定是氧化还原反应,故C错误;
D.放出的热量=反应物的总能量-生成物的总能量=E1-E3,故D错误.
故选:B.
点评 本题考查吸热反应和放热反应,原电池和电解池的工作原理,化学反应中的能量变化,难度不大,学习中注意掌握原电池的工作原理.

练习册系列答案
相关题目
7.一定条件下,在密闭容器中进行可逆反应:N2(g)+3H2(g)?2NH3(g),能说明该反应已达到平衡状态的是( )
| A. | 各物质的质量分数相等 | B. | c(NH3)保持不变 | ||
| C. | 各物质的浓度相等 | D. | c(N2):c(H2):c(NH3)=1:3:2 |
5.下列说法或表示方法正确的是( )
| A. | 反应物的总能量低于生成物的总能量时,该反应在常温下一定不能发生 | |
| B. | 已知C(s)+CO2(g)═2CO(g);△H1和C(s)+$\frac{1}{2}$O2(g)═CO(g);△H2,则△H1<△H2 | |
| C. | 已知:2SO2 (g)+O2 (g)?2SO3 (g);△H=-98.3kJ/mol.将1mol SO2和0.5molO2充入一密闭容器中反应,放出49.15kJ的热量 | |
| D. | 由石墨比金刚石稳定可知:C(金刚石,s)=C(石墨,s);△H<0 |
12.如表列出了①~⑨九种元素在周期表中的位置:
请按要求回答下列问题.
(1)元素④在周期表中所处位置第二周期ⅥA族⑤、⑥、⑦三种元素形成的离子,离子半径由大到小的顺序是P3->S2->Na+.
(2)按气态氢化物的稳定性由弱到强的顺序排列,⑥④⑦的氢化物稳定性:PH3<H2S<H2O(写氢化物的化学式).
(3)元素⑦的原子结构示意图是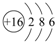 .
.
(4)用电子式表示①与⑨反应得到的化合物的形成过程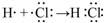 .
.
| ⅠA | ⅧA | |||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | ⑧ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑨ | ||||
(1)元素④在周期表中所处位置第二周期ⅥA族⑤、⑥、⑦三种元素形成的离子,离子半径由大到小的顺序是P3->S2->Na+.
(2)按气态氢化物的稳定性由弱到强的顺序排列,⑥④⑦的氢化物稳定性:PH3<H2S<H2O(写氢化物的化学式).
(3)元素⑦的原子结构示意图是
 .
.(4)用电子式表示①与⑨反应得到的化合物的形成过程
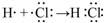 .
.
2.实验室下列物质的保存方法中,不正确的是( )
| A. | 铝片放在不密封的容器里 | |
| B. | 氢氧化钠溶液盛装在用玻璃塞的试剂瓶中 | |
| C. | 硫酸亚铁溶液存放在加有少量铁粉的试剂瓶中 | |
| D. | 金属钠保存在石蜡油或煤油中 |
6.如图是198K时N2与H2反应过程中能量变化的曲线图.下列叙述正确的是 ( )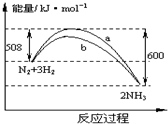

| A. | 该反应的热化学方程式为:N2+3H2?2NH3△H=-92 kJ•mol-1 | |
| B. | 加入催化剂,该化学反应的反应热改变 | |
| C. | b曲线是加入催化剂时的能量变化曲线 | |
| D. | 加入催化剂可增大正反应速率,降低逆反应速率 |
7.以NA代表阿伏加德罗常数,则关于热化学方程式C2H2(g)+$\frac{5}{2}$O2(g)?2CO2(g)+H2O(l)△H=-1 300kJ•mol-1的说法中,正确的是( )
| A. | 当10NA个电子转移时,该反应放出1 300 kJ的能量 | |
| B. | 当1NA个水分子生成且为液体时,吸收1300 kJ的能量 | |
| C. | 当2NA个碳氧共用电子对生成时,放出1300 kJ的能量 | |
| D. | 当4NA个碳氧共用电子对生成时,放出1300 kJ的能量 |
